作者:丁客
2019 年 3 月 28 日,国家药品监督管理局(NMPA)官网显示, PD-1 免疫检查点抑制剂帕博利珠单抗联合培美曲塞和铂类化疗药物一线治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌的适应证正式获批 受理号:JXSS1800018。
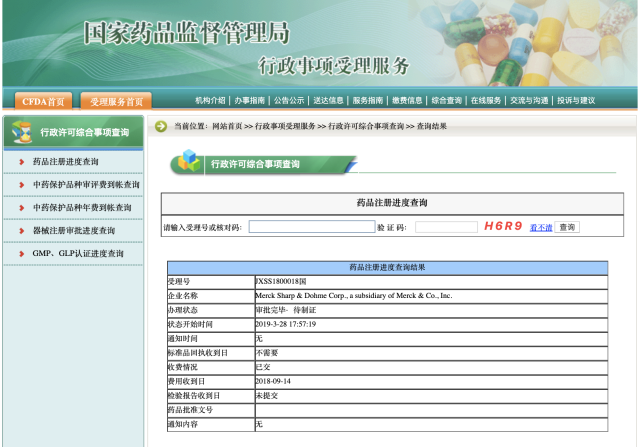
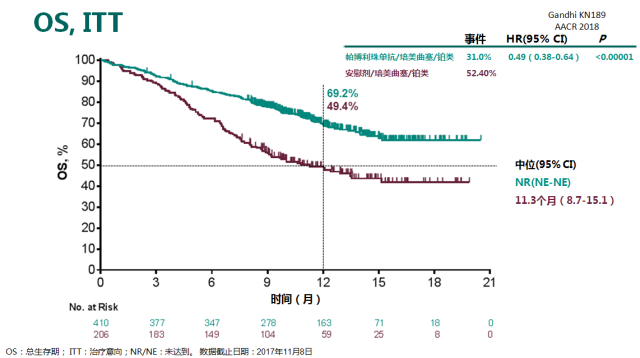
此次帕博利珠单抗(国内俗称「K 药」)适应证的获批是基于一项名为 KEYNOTE-189 的 III 期临床研究的结果。该研究是一项随机、双盲研究,旨在评估帕博利珠单抗联合培美曲塞与铂类化疗(以下简称「K+C」)治疗转移性非鳞状非小细胞肺癌患者的疗效。研究结果显示,截至 2017 年 11 月 8 日,在中位随访 10.5 个月的时候,就已观察到「K+C」组相比对照组带来显著的总生存(OS)的改善,与对照组相比「K+C」组患者死亡风险降低 51%(HR = 0.49; 95% CI, 0.38 to 0.64; P<0.00001)。
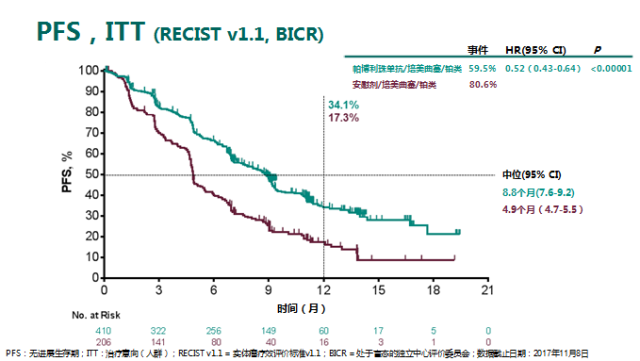
与对照组相比,「K+C」治疗方案能显著改善患者的无进展生存期(PFS),疾病进展或死亡风险降低 48%(HR = 0.52; 95% CI, 0.43 to 0.64; P<0.00001)。
一线免疫治疗方案「照亮」了月球的另一半
我国每年新发肺癌患者约 78.1 万,表现为非小细胞肺癌(NSCLC)患者大约占 85%,其中非鳞状 NSCLC 约占四分之三,而无 EGFR, ALK 等驱动基因突变患者人数约占其中的 65%,逾 30 万。

对于 EGFR 驱动基因突变阳性的晚期 NSCLC 患者, 第一代针对 EGFR 驱动基因突变阳性的 TKI 小分子肿瘤靶向治疗药物一线治疗已经显示了很好的疗效, 中位无疾病进展生存(PFS)达到 10.2 个月;而且随着新一代 TKI 靶向药物的不断涌现,耐药问题也得到有效的解决, 中位 PFS 可获延长近一倍。 而新一代治疗 ALK 融合 NSCLC 的靶向药物可以提升中位 PFS 至 25 个月以上,降低疾病进展和死亡风险 66%。对于这部分晚期肺癌患者,把肺癌变成慢性病已经是一个可实现的目标。
但是对于那些无驱动基因突变 NSCLC 患者,在没有免疫治疗之前,可选择的治疗方案有限,常规的治疗就是化学治疗,但疗效不尽人意,中位总生存不到一年。
广东省肺癌研究所名誉所长、广东省人民医院终身主任吴一龙教授指出,
「此次「K+C」一线联合治疗方案的获批意味着无 EGFR, ALK 等驱动基因突变的所有晚期非鳞状 NSCLC 患者(无论 PD-L1 表达情况)一旦被确诊,都可以考虑给予「K+C」联合方案治疗,无需等化疗失败以后再用肿瘤免疫治疗药物,这有望显著提升这些晚期肺癌患者的总生存(OS)获益和无疾病进展生存(PFS)获益。」
从二线到一线的飞跃
2018 年 6 月 15 日,纳武利尤单抗(国内俗称「O 药」)在国内获批作为二线药物治疗驱动基因突变阴性的晚期转移性非小细胞肺癌(NSCLC),成为国内首个获批的 PD-1 单抗。 自此以后,帕博利珠单抗(国内俗称「K 药」),以及两个国产的 PD-1 单抗相继在国内获批,但也都只是作为二线或者二线以上的方案治疗转移性黑色素瘤或复发/难治性经典型霍奇金淋巴瘤。 此次「K 药」联合化疗一线治疗方案的获批,意味着在短短的 9 个多月内,国内已经有两个 PD-1 单抗获批治疗晚期肺癌,而且我国的肿瘤免疫治疗已经完成从二线到一线的飞跃。 而在美国, 从 2015 年 3 月「O 药」作为首个 PD-1 单抗获批二线治疗鳞状 NSCLC 到 2016 年 10 月「K 药」获批成为首个一线单药治疗 NSCLC 的 PD-1 单抗,历时 19 个多月。
免疫治疗要早开始
PD-1 免疫检查点抑制剂通过重启人体的 T 细胞功能来杀伤肿瘤细胞,所以患者具备良好的基础免疫功能状态对于最大化免疫治疗疗效至关重要,也就说,患者体内一定要有足够的「免疫士兵」; 假如 T 细胞没有了, DC 细胞和巨噬细胞也没有了,用了 PD-1 单抗效果也不会好。
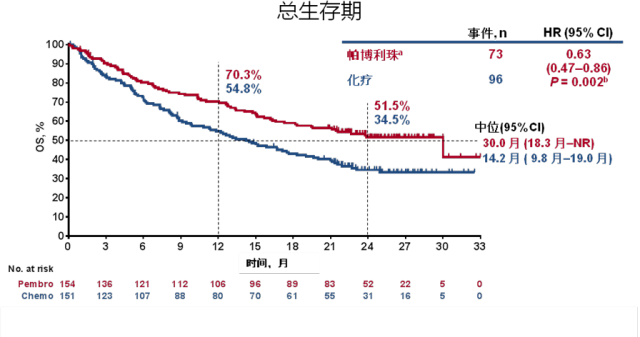
2016 年 10 月 24 日, 美国 FDA 基于帕博利珠单抗单药一线治疗的一项 III 期临床研究(KEYNOTE-024)的研究结果批准了「K 药」单药一线治疗的适应证。在 KEYNOTE-024 研究中,化疗对照组的病人在出现疾病进展后转换为使用 PD-1 单抗(就是临床研究中的患者组交叉), 这时 PD-1 单抗就是二线治疗。研究结果显示,帕博利珠单抗单药一线治疗方案比单药二线治疗方案为患者带来更显著的生存获益:
Ø 一线治疗组的中位生存时间达到 30 个月,二线治疗组为 14.2 个月,一线治疗组的总生存期延长了近 16 个月,HR = 0.63,减少死亡风险 37%。
中国临床肿瘤学会(CSCO)非小细胞肺癌专委会主任委员,同济大学医学院肿瘤研究所所长周彩存教授告诫,化疗的反复使用,会损伤患者的基础免疫功能状态; 免疫治疗和靶向治疗还是有很多不同之处。
「我们经常碰到一些医生问为啥用了 PD-1/PD-L1 单抗,但效果不好,甚至有些病人显示无效。当问及是什么时候给患者用 PD-1/PD-L1 单抗时,就发现原来病人是在卧床不起的时候才开始接受 PD-1 单抗治疗的,那怎么会有效呢?所以,在治疗晚期肺癌患者时,免疫治疗一定要早用,越早用越好。」
「假如一个病人第一个周期打了化疗,第二个周期这个病人问能否用「K+C」,我觉得用上去也合适,没有错;但是我不主张免疫治疗用在最后,PS(患者功能状态)也很差了,基础免疫功能也很差了,白细胞升不上来了,你再用 PD-1 单抗的效果可能就不好了。」
PD-1 单抗临床应用会更规范?
笔者曾发文指摘了当前国内临床上一些不科学的 PD-1 单抗临床应用和不规范推广行为(文章链接:PD-1 单抗应用不可超越的「红线」)。笔者认为 PD-1 单抗一线治疗 NSCLC 适应证在国内的正式获批有利于促进 -至少在晚期肺癌的治疗上 - 临床规范使用当前「火爆」的肿瘤免疫类药物,并可在一定程度上起到减少违规药品推广行为的作用。
根据 NMPA 网站查询,「K 药」联合标准化疗一线治疗鳞状 NSCL C 的新适应证申请已于 2018 年 10 月 16 日获得受理,而「K 药」单药一线治疗 PD-L1 表达 ≥ 1% 的 NSCLC 的新适应证申请也已于 2018 年 11 月 9 日获得 CDE 受理;目前这两个申请均处于 CDE 审评中,预计也将在 2019 年获批。 这些适应证的获批, 不但能进一步扩大从 PD-1 单抗一线治疗中获益的中国 NSCLC 患者人群,并给一线治疗方案带来更多的选择,而且也有助于「扫清跑道」,让 PD-1 单抗在晚期肺癌的临床应用更规范。
但是,如何破解由那些把 PD-1 单抗当作「最后一根稻草」的非晚期肺癌患者 - 比如,肝癌,肾癌,胃癌患者等 - 所驱动的「不规范」临床应用问题呢?
虽然在患者的生命面前,一切都是苍白的,但是在当前的医疗环境下,任何「超适应证」临床应用都可能酿成又一个「聊城事件」,把医生从医院推向法院。更何况在不规范推广行为的的驱使和诱惑下, 临床医生在决策时,若稍有不慎就可能会遇到「飞来横祸」。
卫健委 2018 年 9 月发布的《新型抗肿瘤药物临床应用指导原则》(2018 年版)为临床医生超适应证应用那些在国外已获批适应证,或有强有力循证医学证据的 PD-1 单抗类药物有条件地「开了绿灯」,也确实有助于规范 PD-1 单抗类药物的临床应用,为医生应对「黑暗势力」的诱惑和驱使提供了武器,但是这些都无法与「按国家批准的适应证用药" 所带来的「底气」更强有力。
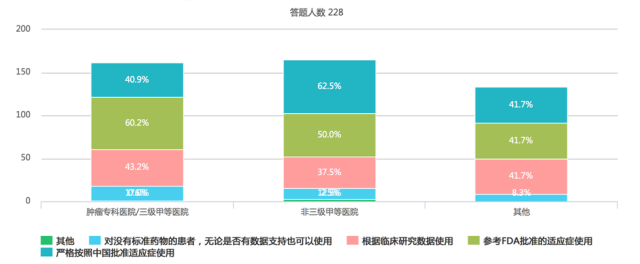
据某肿瘤专业传播平台开展的一项针对 228 名肿瘤治疗相关科室医生的调查结果显示,分别有 40.9% 肿瘤专科/三级甲等医院的医生和 62.5% 的非三级甲等医院医生选择严格按照中国批准的适应证来使用 PD-1/PD-L1 单抗类药物。
因此,笔者认为,如果让已经飞快运转的创新药审批流程「跑得」更快一点,加速批准临床急需的,但有循证医学数据支撑的 PD-1 单抗适应证,目前有点「嘈杂纷乱」的国内 PD-1 单抗市场会变得更有序。
更多一线治疗适应证有望快速获批?
2018 年 12 月 12 日,中国国家药品监督管理局官网刊发了题为《与时代同行,谱写药品监管新篇章-回顾改革开放 40 年药品监管工作》一文,文章提及要加快进口药上市步伐,加快临床急需药品审评审批,促进境外已上市新药尽快在境内上市;对在境外还没上市的创新药,也要力争做到境内外同步上市。
2019 年 2 月 19 日,在国务院政策例行吹风会上,国家药品监督管理局药品注册司司长王平指出, 2019 年将继续提速抗肿瘤新药的审批进程,进一步完善临床急需的境外新药的专门通道的审批机制,继续组织专家遴选第二批临床急需境外新药的品种,纳入到专门通道,以加快上市进程。
近来,PD-1 单抗一线治疗多个恶性肿瘤的 III 期临床研究结果相继公布,包括「K 药」联合抗血管生成小分子靶向药物仑伐替尼一线治疗晚期肝癌,「K 药」联合多靶点小分子靶向药物阿昔替尼一线治疗初治进展期肾细胞癌, K 药」单药或联合化疗一线治疗头颈部鳞癌等研究结果。这些研究结果都显示了 PD-1 单抗一线治疗比传统的标准治疗带来更优越的疗效和/或生存获益。
值得关注的是,在药品审批改革的「飓风」推动下,这些临床研究结果是否能被国内药监部门视为如 KEYNOTE-189 结果一样的「亮眼」,从而鼓励企业积极申报适应证上市,「力争做到境内外同步上市」,让国内身患不同肿瘤的患者都能像晚期 NSCLC 患者一样,「赶早」从一线免疫治疗方案中获得生存「红利」。
