前些天,跟大家分享了「直肠癌 MRI 入门秘籍」,大受好评。这次,我们来聊聊「直肠癌 MRl 入门口诀」。
所谓直肠癌 MRl 入门口诀,即「DISTANCE」,通过这个单词,我们可以更快速更有逻辑的掌握直肠癌 MRI 要领。该文编译自 2013 年的一篇经典文章,我自己也听过北大人民医院的王屹教授、协和医院的薛华丹教授以此口诀讲授直肠癌的 MRI,特分享之。
口诀 1:「DIS」——从肿瘤下缘到移行皮肤的距离
明确以下几点:
1. 肛缘是肛管末端由肛门皮肤和肛周皮肤之间形成的过渡区域。
2. 肿瘤水平是从肿瘤隆起边缘的最末端到肛缘测量。
3. 因为预后和手术治疗方式受肿瘤位置的影响,传统上直肠分为 3 段:
(1)高位:肿瘤的最下缘距离肛缘超过 10 cm。高位直肠前壁被腹膜返折覆盖,肿瘤腹膜穿孔的风险较高,应仔细的解剖以减少肿瘤播散。
腹膜返折附着点的高度可变,尤其是在女性中,甚至可以低至距离肛缘 5 cm。此部位肿瘤需仔细评估腹膜返折。
(2)中位:肿瘤的最下缘距离肛缘 5~10 cm。位于腹膜返折下方的直肠完全被直肠系膜包绕,适用于 TME。手术切缘由直肠系膜筋膜形成, 是 TME 手术的解剖平面。
(3)低位:肿瘤的最下缘距离肛缘小于 5 cm。在这个水平上,直肠的直径逐渐变细。直肠系膜筋膜与残留的泌尿生殖隔相融合,是一个致密的筋膜带(男性的 rectoprostatic 筋膜,女性的直肠阴道间隔)。肛管直肠结合部被耻骨直肠韧带向前拉伸。
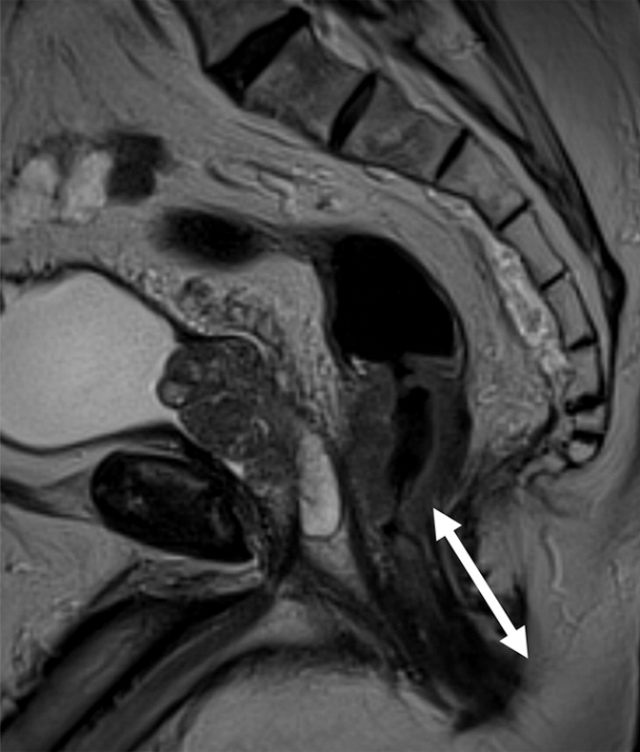
图 1 低位直肠癌患者的矢状 T2 加权图像。箭头显示肿瘤下缘距离肛缘 <5 cm。测量必须以相对直线的方式进行,以便与乙状结肠镜检查相符。
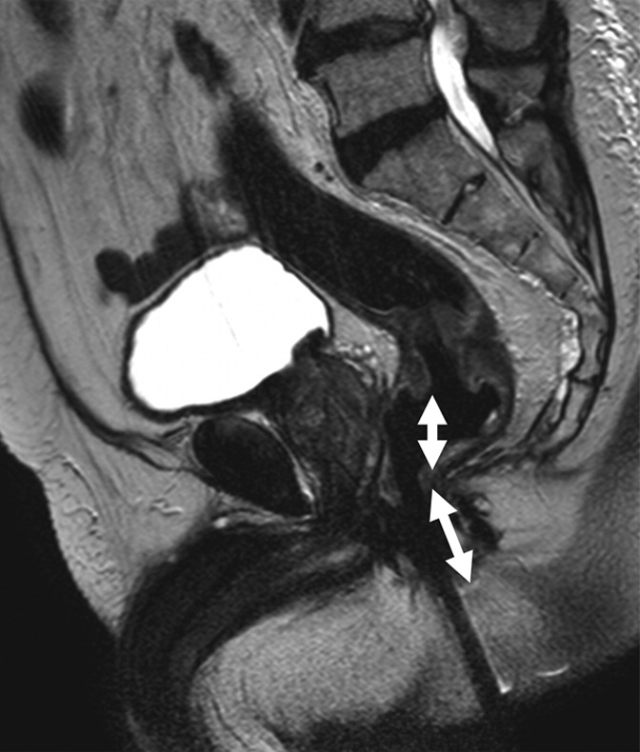
图 2 中位直肠癌患者的矢状 T2 加权图像。箭头显示肿瘤下缘距离肛缘 5~10 cm。
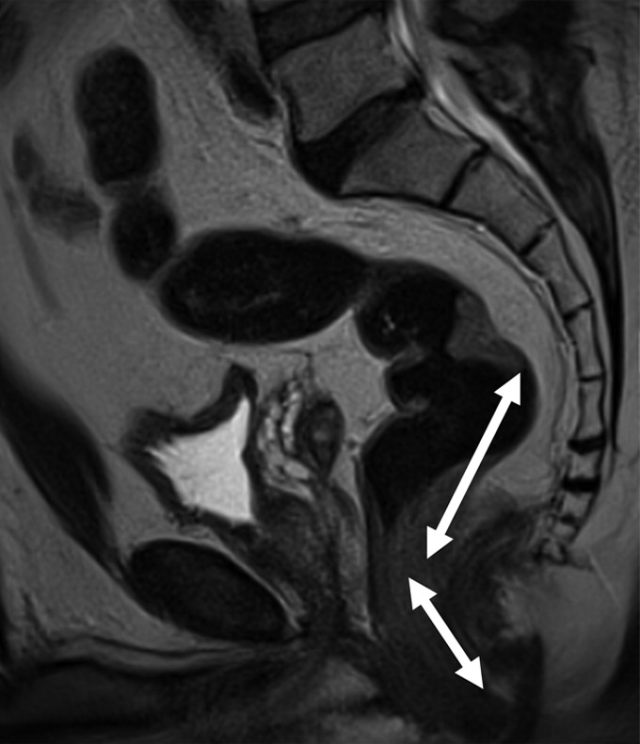
图 3 高位直肠癌患者的矢状 T2 加权图像。箭头显示肿瘤下缘距离肛缘 >10 cm。
口诀 2:「T」——T 分期
MR 成像中,直肠癌的 T 分期很大程度上取决于肿瘤、粘膜下层、肌层和直肠系膜间 T2 信号强度的差异。
T1 直肠癌局限于粘膜和粘膜下层;T2 肿瘤侵袭了固有肌层;T3 病变超过固有肌层。
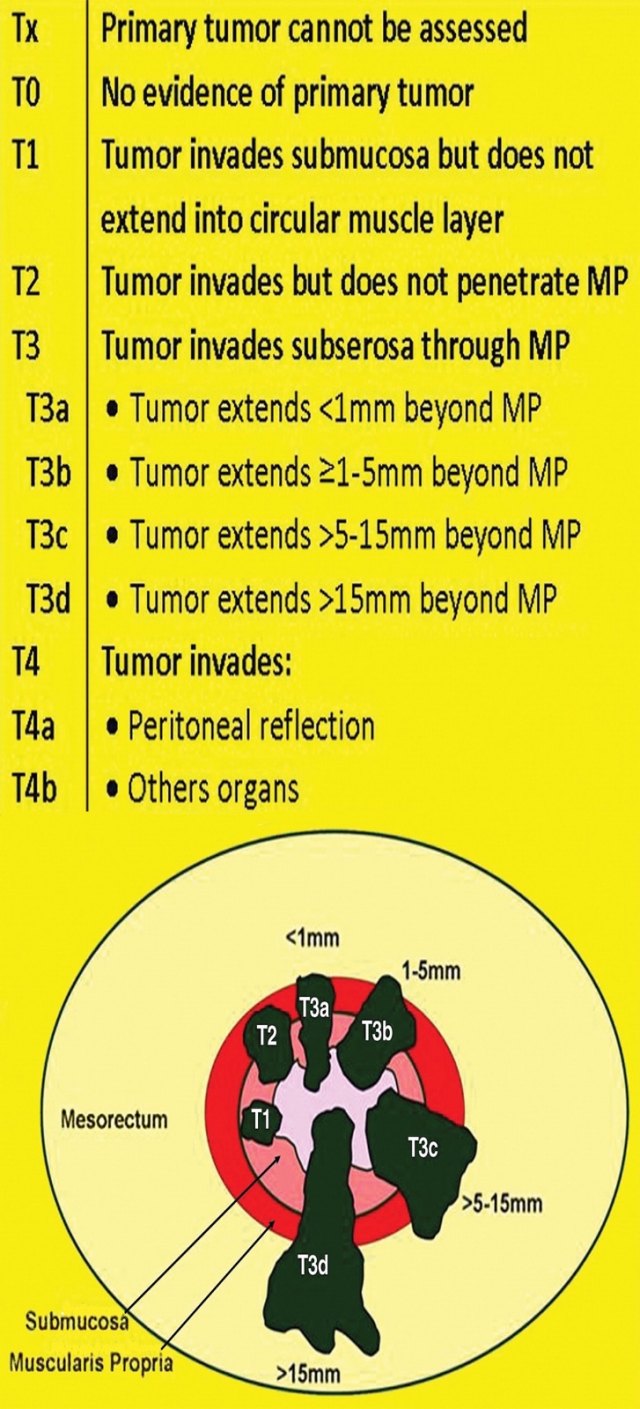
图 4 直肠癌 T 分期示意图
1. T1 和 T2
MR 无法区分肿瘤是局限于黏膜下层还是浸润至固有肌层,直肠内超声(US)能够更准确地区分 T1 和 T2。T1~2 期肿瘤未穿透肠壁,预后较好,T1~2 期 MRI 上可见直肠肠壁完整的黑色边界。
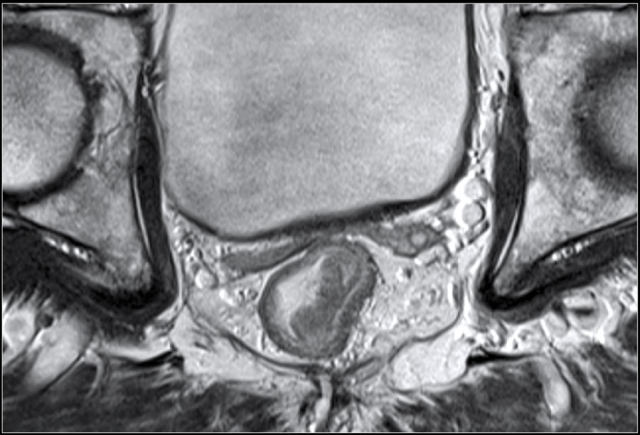
图 5 远端直肠半圆形 T2 肿瘤,与外部肌层分界明显
2. T3
MRI 检测直肠周围组织浸润的敏感性为 82%,肿瘤侵犯或结缔组织增生反应均可表现为直肠周围浸润,为了避免分期不足,出现直肠周围浸润即作为 T3 期肿瘤。
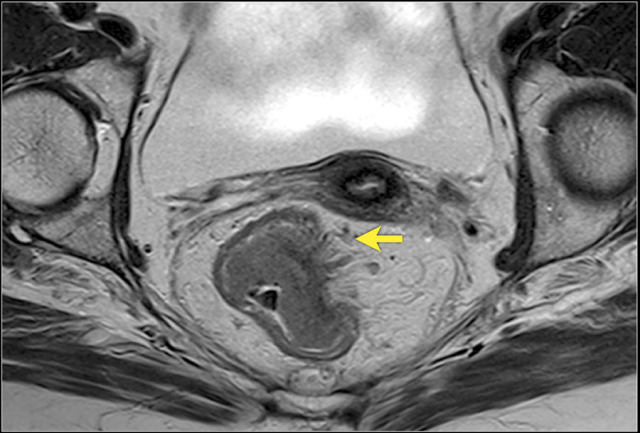
图 6 T3 直肠癌 MRF-,肿瘤浸润直肠系膜,1~4 点钟位置

图 7 直肠周围浸润(左);肿瘤局限于肠壁(右)
3. T3 累及 MRF
在 T3 肿瘤的描述中,报告应包括肿瘤边缘和 MRF 之间的最短距离。MRF 阳性导致局部复发的风险增加(当肿瘤边缘和 MRF 之间的距离小于 1 mm 时,MRF 被认为是阳性)。
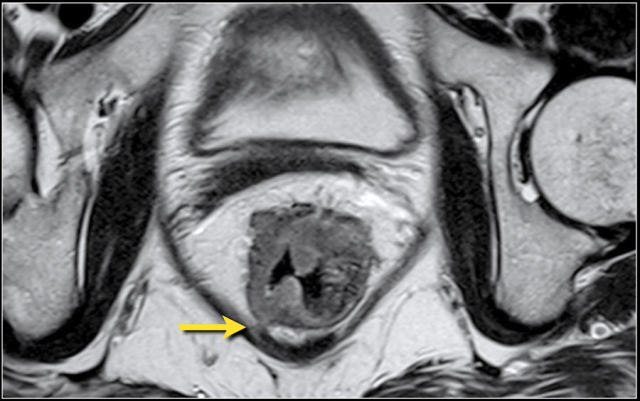
图 8 T3 直肠癌 MRF+
4. T3 亚分期
基于英国 MRC 的 MERCURRY 研究所确立的标准,高分辨率 MRI 下,按照原发肿瘤突破肠壁固有肌层后侵入直肠系膜内的垂直距离来区分,按 1 mm,1~5 mm,6~15 mm,>15 mm 将 T3 分为 a、b、c、d 四个亚组。
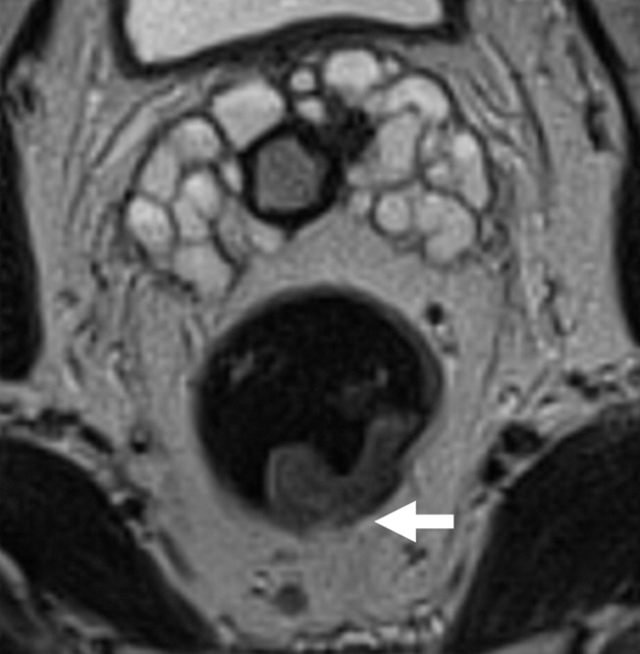
图 9 T3a<1 mm
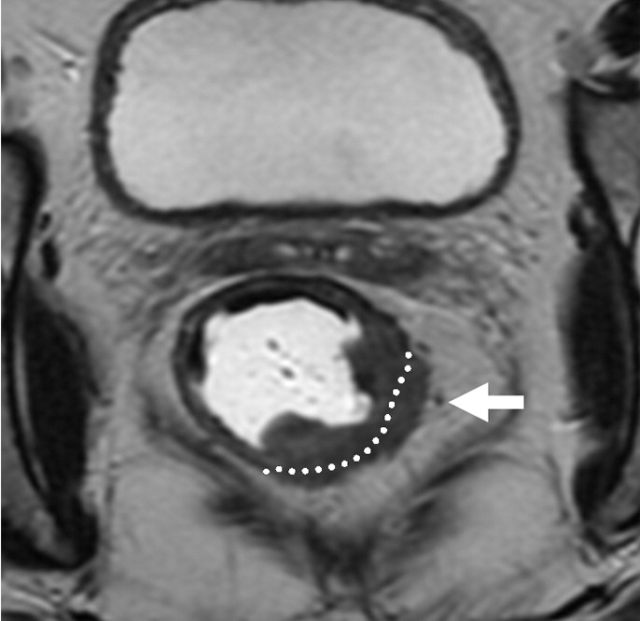
图 10 T3b:1~5 mm
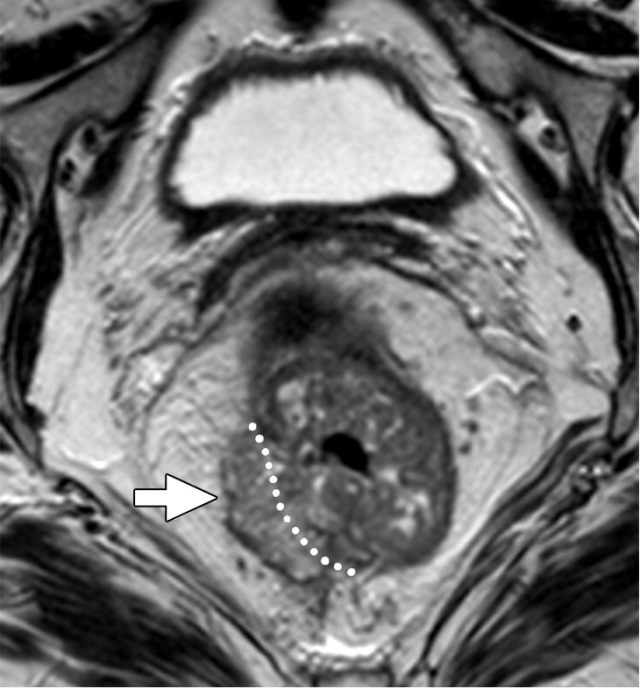
图 11 T3c:5~15 mm
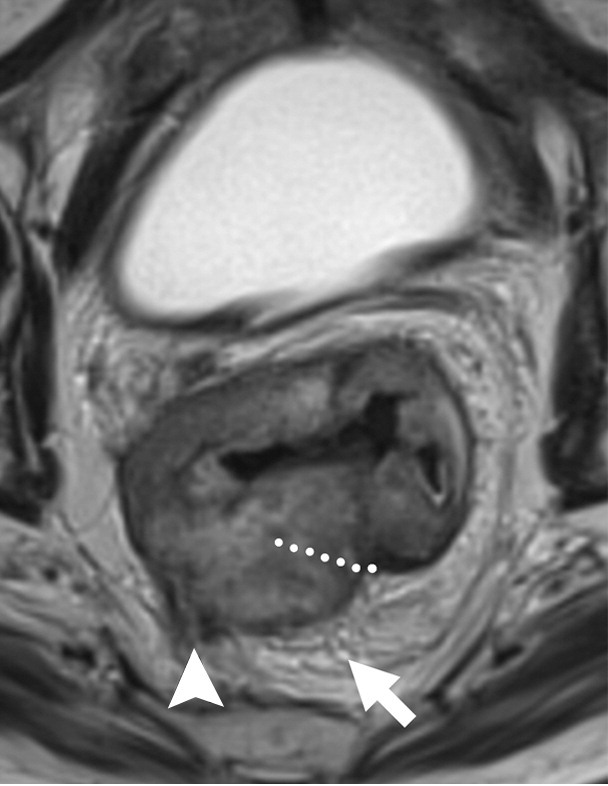
图 12 T3d >15 mm
而北美放射学会用的是 T3abc 亚分期,更为简洁:
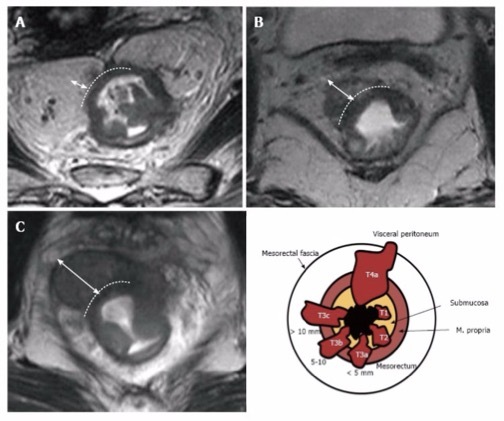
图 13 北美 T3abc 的定义
5. T4a 侵出腹膜反折
低直肠完全被直肠内筋膜覆盖。在直肠中部,其后侧和外侧由直肠内筋膜覆盖,但在前侧由内脏腹膜覆盖。内脏腹膜生长意味着扩散到腹膜腔。在矢状 T2 加权图像上,腹膜反折可以描绘为连接膀胱与直肠前后方面的低信号细线。
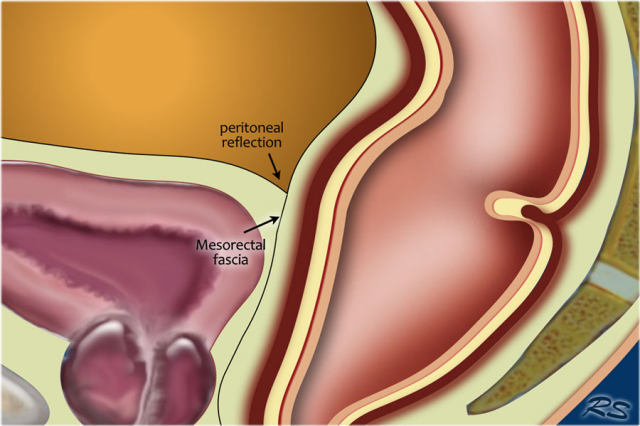
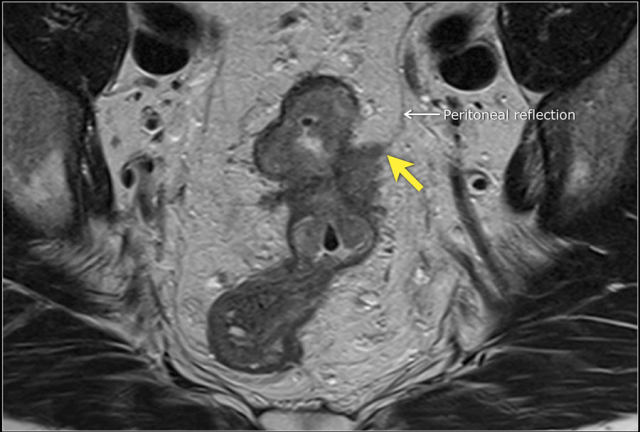
图 14 轴向 T2 加权图像上,沿着内脏腹膜有肿瘤向内生长(箭头)
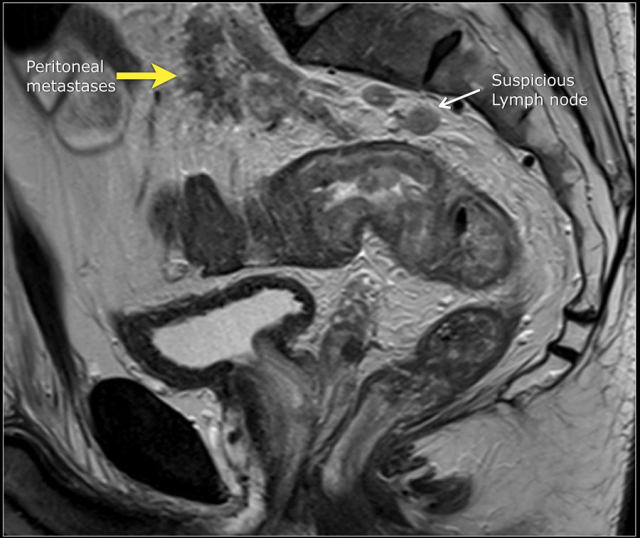
图 15 同一患者腹膜转移的矢状图(箭头),在直肠内还有可疑的淋巴结
6. T4b 侵入周围器官
T4 期肿瘤侵犯周围结构,如盆壁、阴道、前列腺、膀胱或精囊,这类局部晚期患者需要进行长程放化疗和广泛切除。
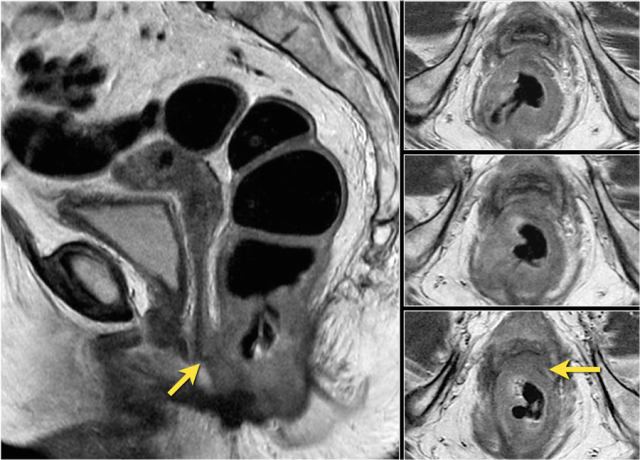
图 16 在矢状 T2W 图像上,直肠和阴道后壁之间有脂肪平面的损失。在轴向图像上,看到肿瘤的相对低的信号强度延伸到阴道的后壁(箭头)
以下 5 幅图例请连续观看:
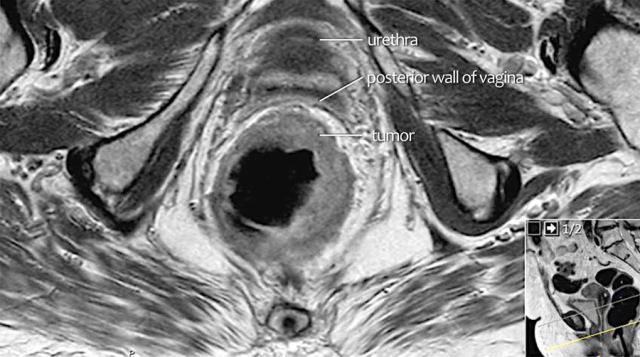
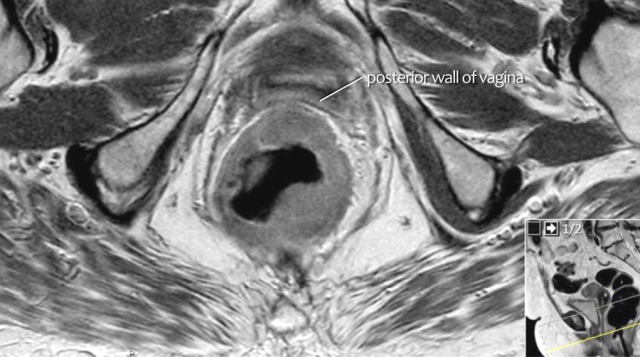
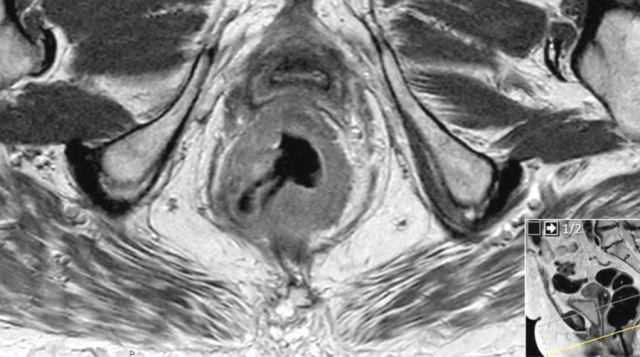
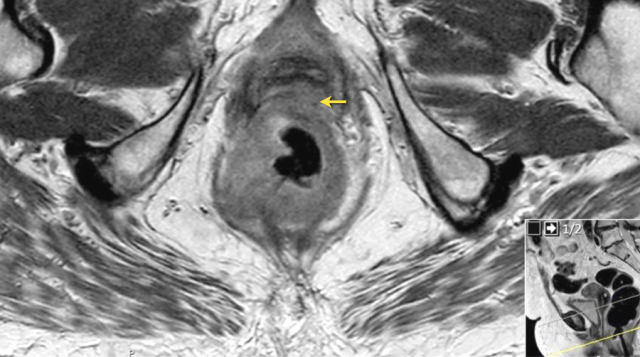
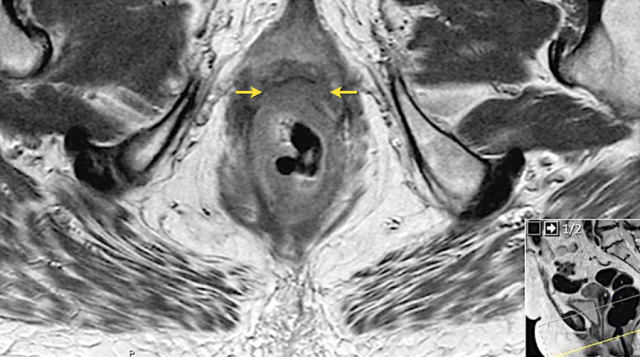
图 17~21 肿瘤的低信号强度延伸到阴道的后壁(箭头)
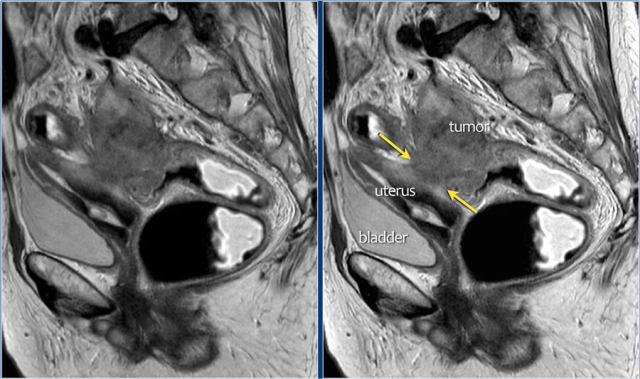
图 22 浸润到子宫后壁的肿瘤
口诀 3:「A」——肛门复合体 - 括约肌和直肠肌
肛管直肠结合部,直肠固有肌层变化:1. 环形肌变厚形成内括约肌。2. 外括约肌复合体由肛提肌最下部,耻骨直肠肌和外括约肌组成。3. 低位肛管中两个括约肌形成明显的括约肌间隙。
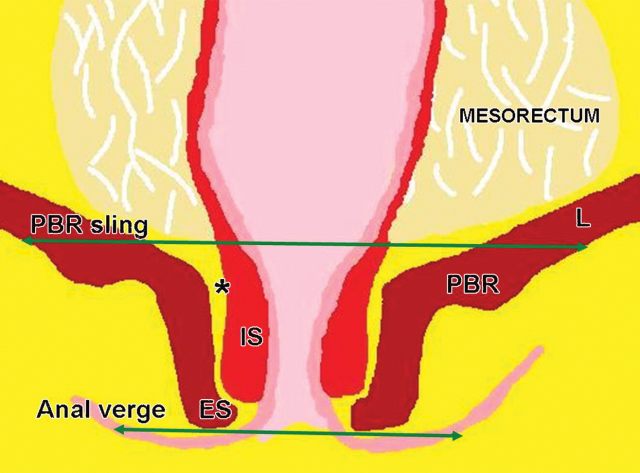
低直肠肿瘤与阳性切缘率较高,局部复发率高,存活率差相关。这主要是由于解剖学考虑以及直肠系膜在此水平下降的事实。
有学者提出了一种低直肠肿瘤 T 分期。这种分期是基于冠状和轴向 T2 加权图像。
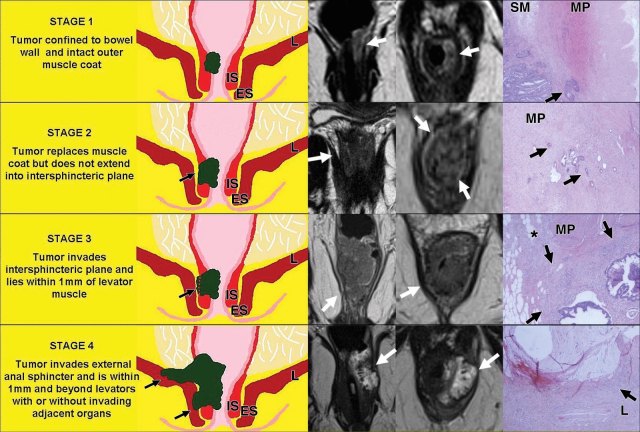
对于低直肠肿瘤,可以根据肿瘤分期进行三种不同的手术方式。
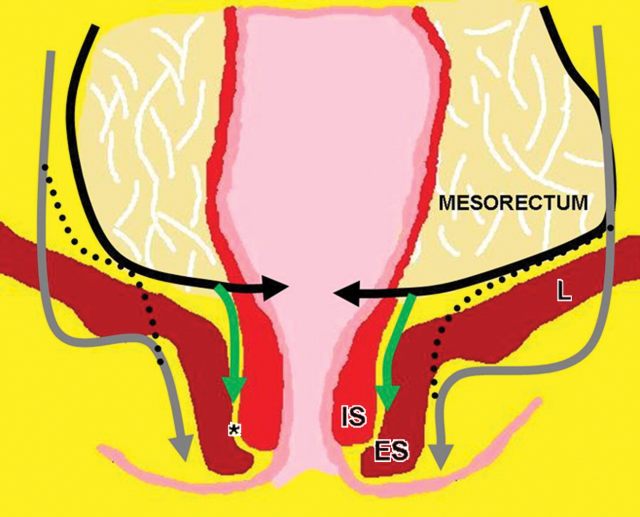
图 23 手术方式。黑色线:TME;绿色线:ISR;灰色线:ELAPE
口诀 4:「N」——淋巴结分期
精确的淋巴结分期是重要的,因为转移淋巴结的数量影响预后。在 MRI 图像上确定淋巴结受累,传统上依赖于尺寸评估。然而反应性和转移性淋巴结之间,在尺寸上存在相当大的重叠。此外,正常大小的淋巴结中常见微转移。因此不提倡用大小来评估淋巴结是否存在肿瘤。
基于形状、边界和信号强度的标准已经被证明是更可靠的。使用这些标准,与组织病理学评估相比,MRI 确定淋巴结受累的准确度为 85%。然而阴性 MRI 成像不能排除淋巴结转移,因为成像技术不能确定淋巴结内的微转移。
以下是淋巴结分期诊断线索:
1. 均匀的淋巴结小于 10 mm,具有均匀信号强度不可疑。
2. 具有不规则边界和/或混合信号强度是可疑的。
3. 存在 1~3 个可疑淋巴结是 N1,存在 4 个或更多个是 N2。
4. 必须报告位于 CRM 1 mm 以内的任何淋巴结,因为它高度可疑 CRM 阳性。
5. 记录任何可疑骨盆侧壁淋巴结的位置和大小,这将改变放射治疗靶区。其次,外科医生将需要进行扩大淋巴结切除术(髂内淋巴结清扫)。
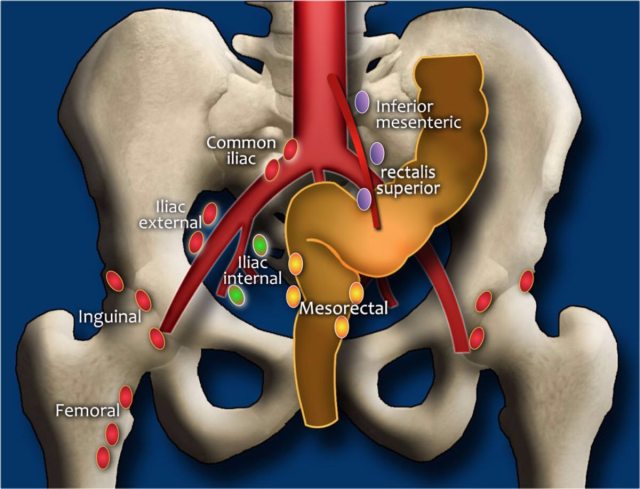
图 24 直肠区域淋巴结
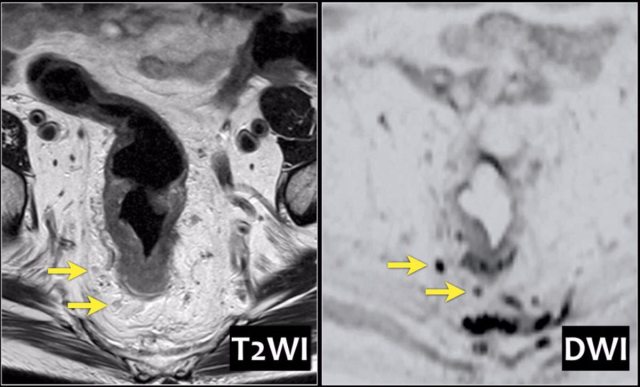
图 25 DWI 有助于检测淋巴结
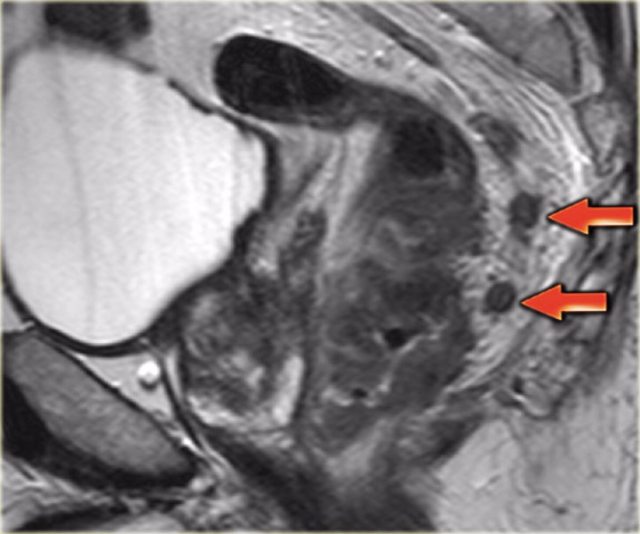
图 26 矢状位 T2W 图像下,低直肠癌,在后侧的直肠内脂肪中有多个淋巴结。有些淋巴结具有异质性,并且具有不规则的边界
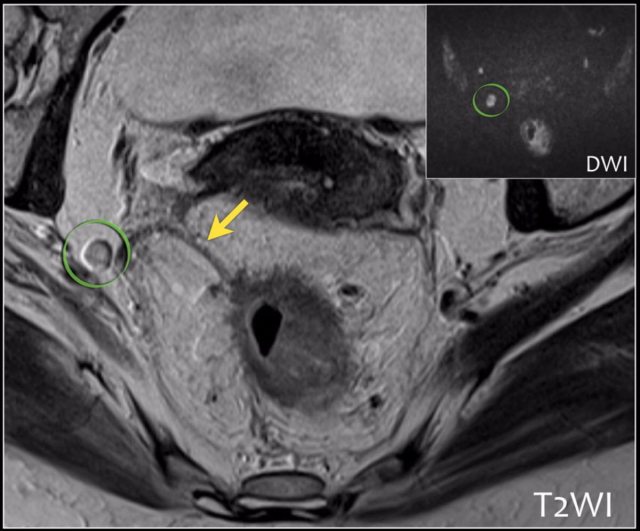
图 27 直肠外淋巴结,可能是局部复发的原因,在标准 TME 中不切除这些淋巴结
口诀 5:「C」——环周切缘 CRM
直肠系膜筋膜是包围直肠周围脂肪和直肠的低信号,代表 TME 切除术中的手术切除平面。在 MR 图像上,是进行 TME 手术患者的潜在 CRM。CRM 阳性是局部复发和预后差的一个重要的独立预后因素。
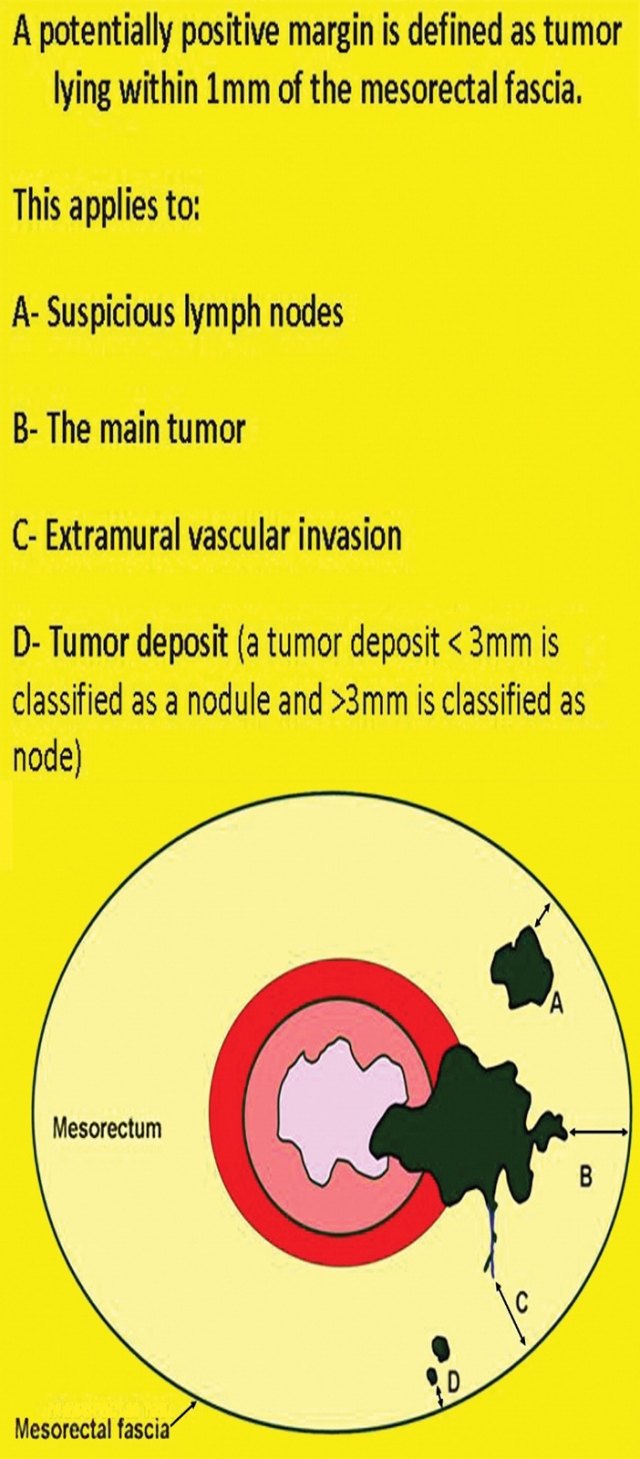
图 28 CRM 阳性的示意图(影像环周切缘的 4 个因素)。A:淋巴结;B:原发病灶;C:壁外浸润 EMVI;D:肿瘤沉积
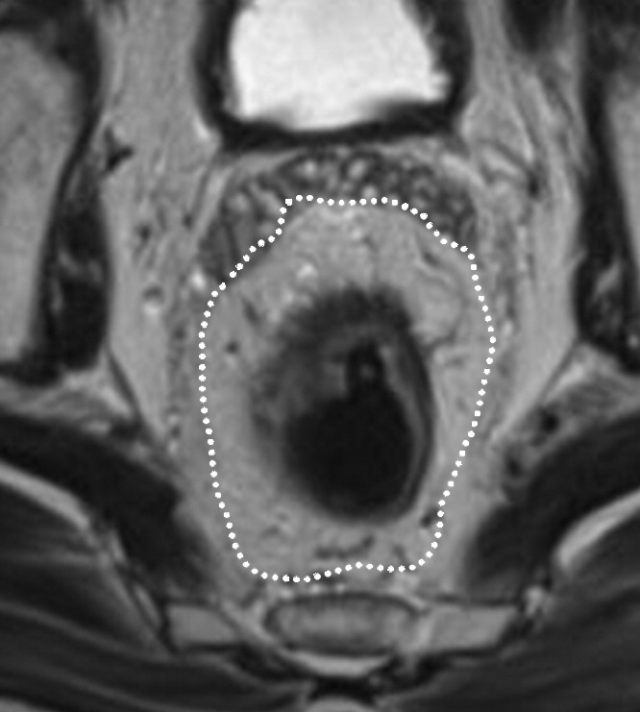
图 29 轴向 T2 加权图像报告 CRM 的距离。虚线描绘了直肠系膜筋膜,这是 T3a 肿瘤的 CRM,预测 CRM 阴性
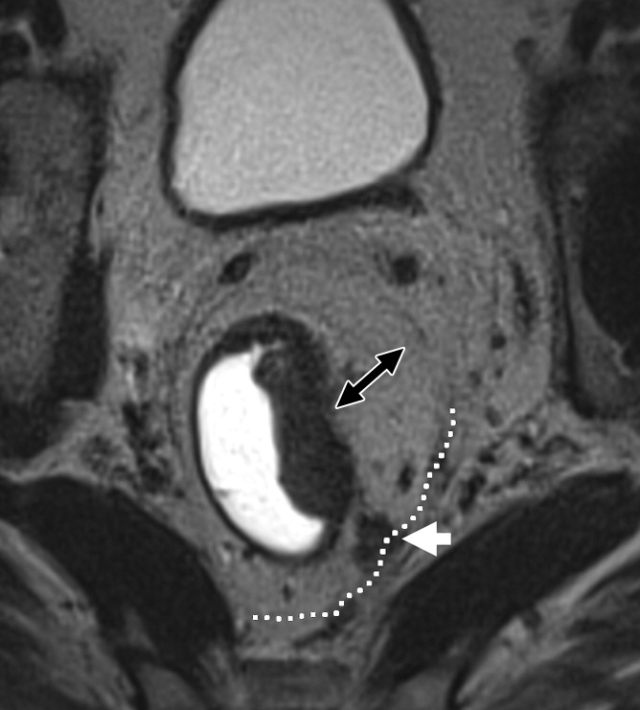
图 30 轴向 T2 加权图像报告 CRM 的距离。T3a 肿瘤远离直肠系膜筋膜(黑色箭头),但直肠系膜筋膜上的可疑淋巴结(白色箭头)提高了 CRM 阳性(CRM = 0 mm)的可能性。
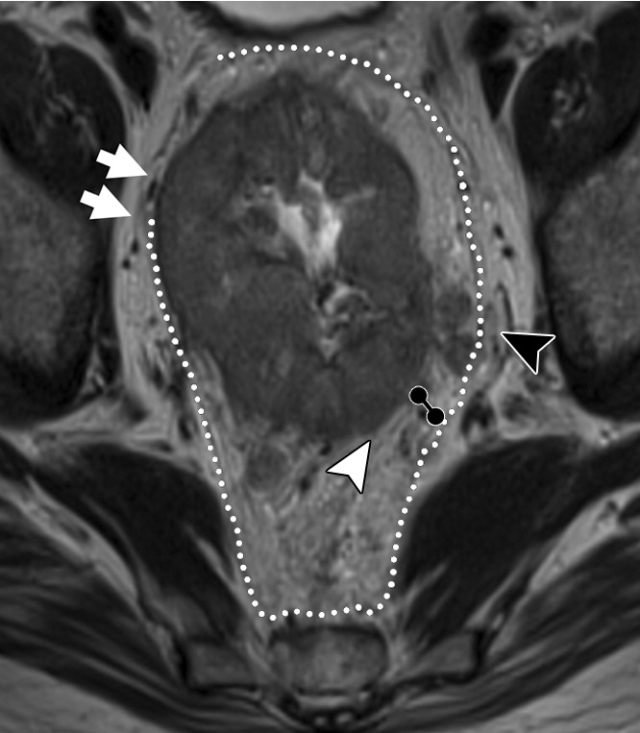
图 31 轴向 T2 加权图像报告 CRM 的距离。T3d 肿瘤局限于固有肌层内,肿瘤毗邻直肠系膜筋膜(箭头;肿瘤为 T2)。侵犯边界似乎是左后方(白色箭头),肿瘤的 CRM 评估为 5 mm。但有两个混合信号强度淋巴结(黑色箭头)邻接直肠,导致 CRM 为 0 mm。
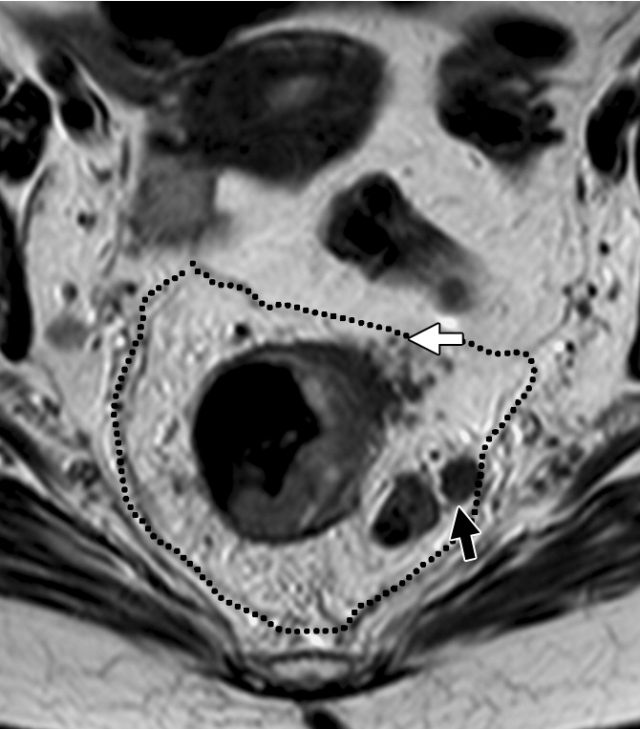
图 32 轴向 T2 加权图像报告 CRM 的距离。T3c 肿瘤,靠近腹膜的 EMVI(白色箭头)和不规则信号强度淋巴结的 T3c 肿瘤,通过毗邻直肠系膜筋膜的淋巴结包膜(黑色箭头)肿瘤扩展(预测 CRM = 0 mm)。
口诀 6:「E」——壁外血管侵犯 EMVI
多达一半的结直肠癌病例发生 EMVI,是局部复发、远处转移和较差 OS 的独立危险因素。EMVI 是在直肠固有肌层以外直肠系膜的血管内存在恶性细胞。MR 成像描绘的 EMVI 的严重程度与 DFS 相关。
EMVI 的诊断线索:
1. 根据定义,EMVI 必须与至少 T3 类肿瘤有关。T1 或 T2 不具有侵入外部血管的潜力。
2. 只要肿瘤靠近血管,就应该考虑 EMVI 的可能性。
3. EMVI 的迹象:(1)在血管结构内存在肿瘤信号强度;(2)血管扩张;(3)肿瘤扩张通过和超出血管壁,破坏血管边界。
4. 最后,如果存在 EMVI,必须考虑所涉及静脉是否威胁到直肠系膜筋膜(即它们是否在筋膜的 1 mm 以内)。
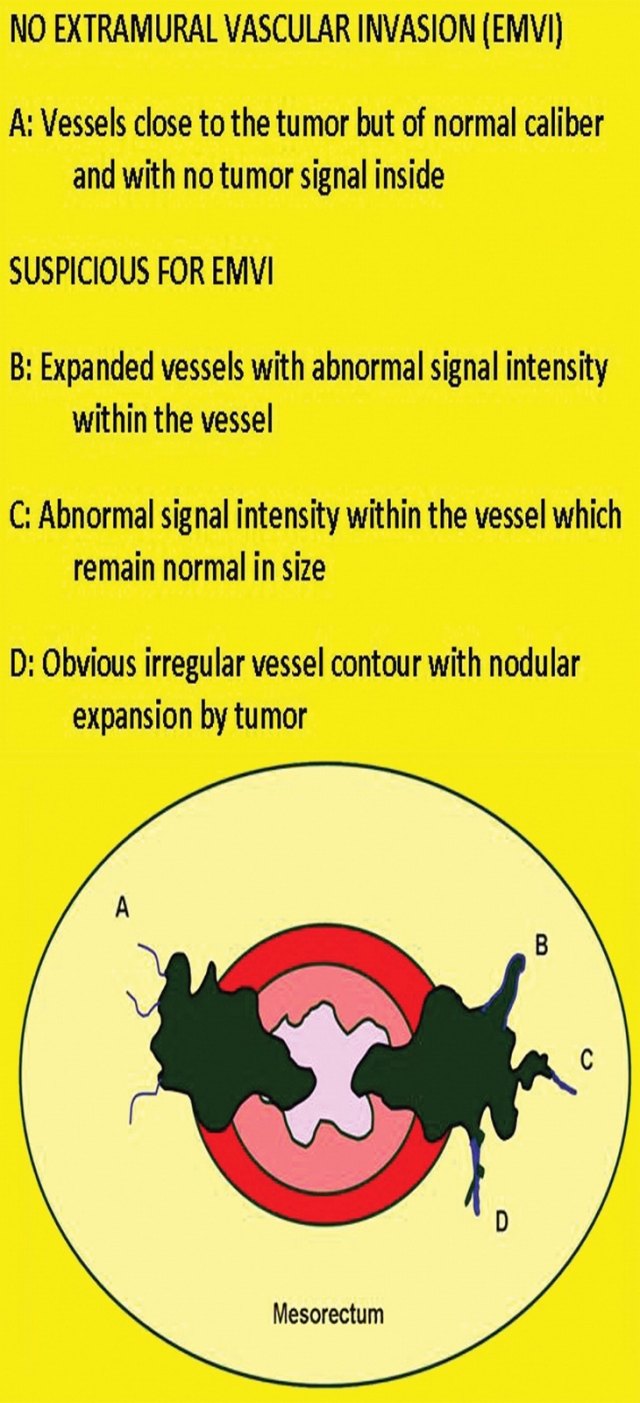
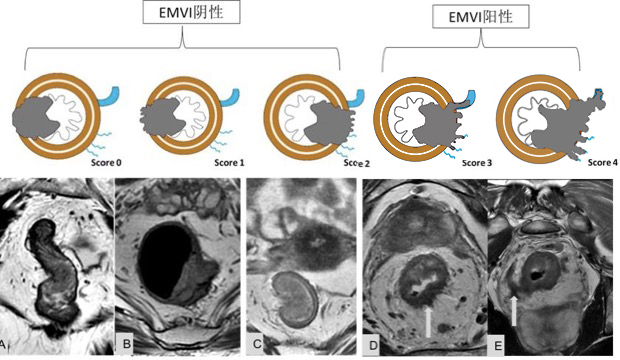
图 33 EMVI 的示意图
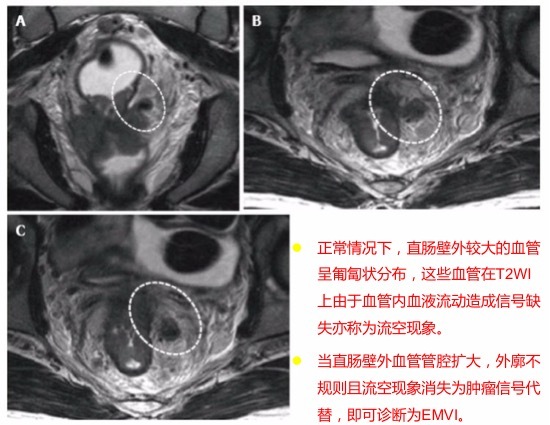
图 34 EMVI
为了更为准确的判断 EMVI,根据肿瘤外形,肿瘤周围是否存在血管,受累血管管径、轮廓及信号的变化,MRI 评估直肠癌 EMVI 的 5 级评分系统,并将评分为 0~2 定义为阴性,3 和 4 的定义为 EMVI 阳性。

学会这个口诀之后,来看看 2017ESMO 直肠癌分层治疗吧。

后记:
中山大学肿瘤防治中心的陈功教授点评:「T」和「A」其实都应该是被归为 T 分期,「T」为肛提肌水平以上直肠的 T 分期,「A」为肛提肌水平以下直肠肛管的 T 分期。
该点评其实道出了低位直肠癌的精䯝,再次附上中高位和低位直肠癌分期:

本文作者:哈尔滨医科大学附属第四医院 孙凌宇
