1. 背景介绍
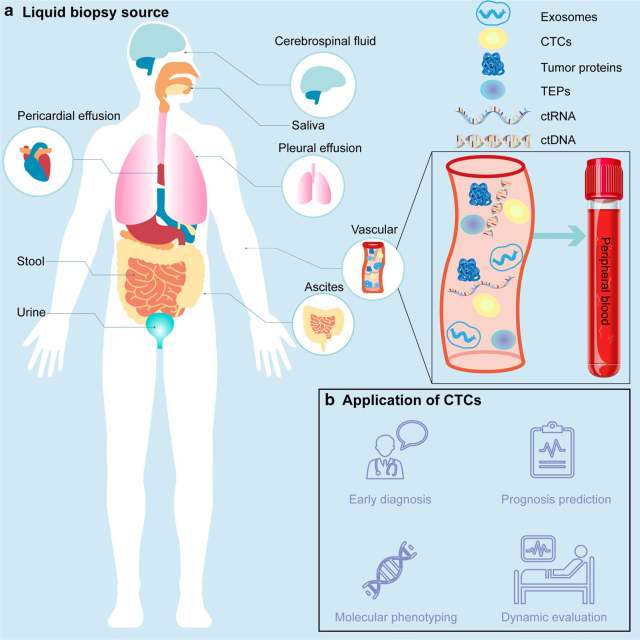
过去十年里,癌症仍是全球第二大死亡因素。癌症的传统治疗方法如手术、化疗等往往忽略了肿瘤患者间的异质性,随着精准医疗的发展,液体活检受到临床关注,与传统组织活检相比,它具有非侵入性和实时性等优势。常见液体活检标志物包括有 CTC、ctDNA、外泌体等,CTC 作为肿瘤转移的种子保留有肿瘤的异质性和肿瘤特性,可作为疾病治疗靶点筛查、动态监测和预后评估的生物标志物,此外 CTC 衍生的 3D 类器官模型在药敏试验和蛋白组学分析方面也具有应用潜力。
2.CTC 分离鉴定技术
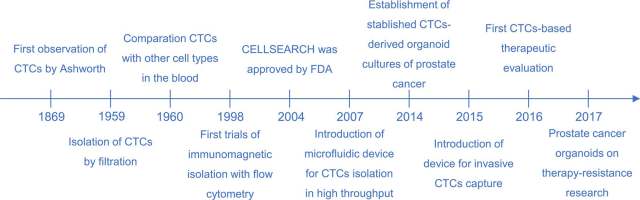
CTC 最初是由 Tomas Ashworth 在 150 年前通过癌症患者的尸检发现的,目前 CTC 已被证实可作为临床预后评估和疗效评价的预测因子,其发展历程如下图。
根据肿瘤细胞的生物学和物理学特性差异,科学家们开发出不同原理的 CTC 分离鉴定技术,随着微融合芯片和纳米技术的出现,CTC 分离技术发展迅速,列表中呈现了部分最新技术。
3.CTC 的临床应用
(1)CTC 作为治疗靶点
CTC 与肿瘤转移相关,而肿瘤转移会导致患者死亡,因而研究者们设想以 CTC 为靶点阻止癌细胞扩散将是一种强有力的治疗策略,但缺乏相应的技术评价。随后 Kim 等人通过清除小鼠体内的绿色荧光蛋白(GFP)-CTC 试验,证实了清除 CTC 可防止肿瘤转移并延长附瘤小鼠的生存期。此外,Rana、Phipps、Mitchell 等人也发现从胞外基质分离或暴露于流体剪切应力中的肿瘤细胞对 TRAIL 治疗敏感性增强。因此,针对晚期癌症患者抗肿瘤播散的新治疗方法是可行的。
(2)CTC 在液体活检中的应用
◆预后评估
CTC 具有异质性,检测中应重点关注导致肿瘤转移的 CTC 亚群,且了解 CTC 的分子和生物学特性可以指导临床决策。Miyamoto 等人已实现对微流控技术富集的前列腺癌 CTC 转录本进行数值化定量,以预测转移和预后;另有研究分析显示激素受体阳性的乳腺癌患者 CTC 检测阳性,可为肿瘤复发提供独立预后结果。◆早期诊断
CTC 作为转移的种子在肿瘤进展中发挥着关键作用,有研究表明 CTC 可作为早期诊断的生物标志物。Fan 等人发现 CTC panel 在肝硬化、慢性乙型肝炎和肝占位病变的早期诊断和鉴别方面表现突出;Zhou 等人证实了 FR+-CTC 结合最大肿瘤直径(MTD)是判断小尺寸孤立性肺结节(Spn)是否为侵袭性肿瘤的可靠方法。
◆分子表征
PD-L1 抗肿瘤治疗具有较低的毒性和长期疗效,根据 CTC 中 PD-L1 表达水平的高低可对 CTC 进行亚群分层。Maze 等人发现激素受体阳性、HER2 阴性的乳腺癌 CTC 中 PD-L1 表达显著增加。CTC/PD-L1 分析可能适用于免疫检查点阻断治疗的患者免疫治疗效果的评分。
◆动态监测
鉴于癌症的易复发和转移特性,CTC 可作为评价肿瘤侵袭性和指导临床治疗的独立指标。Scher 和 Li 等人分别在去势抵抗性前列腺癌(CRPC)和局部进展期胃癌(LAGC)中证实了 CTC 计数可用于肿瘤的实时治疗评价,而 Balakrishnan 等人亦发现化疗诱导的 CTC 簇形成可预示疾病进展和更短的生存期。
4.CTC 来源的 3D 类器官模型
CTC 衍生的临床前模型包括 2D 培养、球体模型、3D 类器官培养和 CDX 模型,其中 3D 类器官培养具备形态稳定、保存有肿瘤特性、高通量药物筛选、低成本、操作方便等优势,在精准医疗中具有广阔的应用前景。
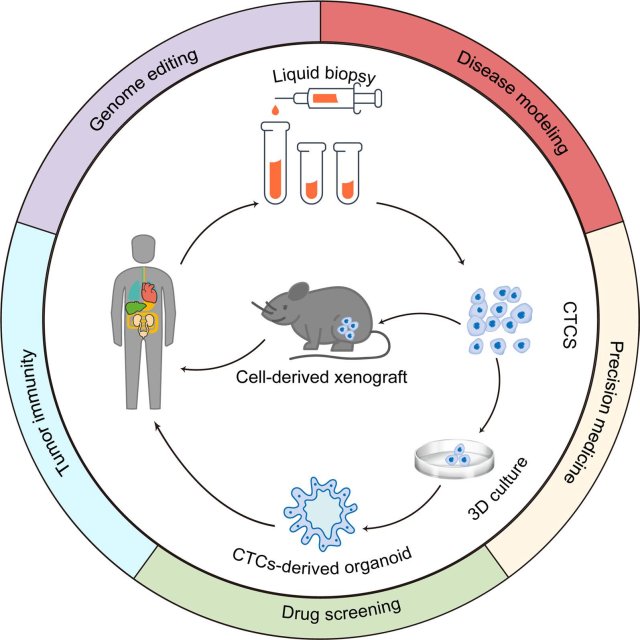
5.CTC-3D 类器官模型的开发
类器官是指在提供特定生长因子的 3D 半固态细胞外基质中生长的微小组织模型。20 世纪 80 年代,Bissell 开发了 3D 培养技术,2009 年 Sato 等在类器官培养获得突破,建立了微型肠道培养体系,随后该技术被广泛应用于结直肠、肺、前列腺、胃、肝、胰腺、乳腺等其他器官进行分子研究和药物筛选。CTC 在血液中非常稀少,因此 CTC-3D 类器官模型建立较晚,2014 年 Zhang 成功设计了 CTC-3D 共培养模型,随着 CTC 分离培养技术的发展,CTC-3D 类器官培养已经广泛应用于临床。
6. CTC-3D 类器官的应用前景
◆疾病建模
肿瘤进展过程复杂多变,给致病基因的筛选造成较大困难,类器官模型在癌症建模和驱动基因识别上具有应用潜力。Drost 和 Fumagalli 等人研究发现四基因突变(APCKO、TP53KO、KRASG12D 和 SMAD4KO)的类器官比三基因突变(APCKO、TP53KO 和 KRASG12D)具有更快的生长和更强的侵袭转移能力。建立患者不同阶段的多类器官生物库,有助于监测肿瘤转移进展。
◆药物开发
CTC-类器官模型对特异性药物筛选至关重要。2014 年 Hodgkinson 研究表明 CTC 类器官外植体可用于监测肿瘤药物的敏感性及筛选新的治疗靶点。之后 Boehnke 和 Sachs 等人成功将类器官应用于结直肠癌和乳腺癌中,揭示了类器官技术在药物反应方面的巨大潜力。
◆精准医疗
精准医疗综合考虑了基因和环境的个体化差异。2015 年 Van de Wetering 报道了单一类器官培养物对 Wnt 分泌的小分子抑制剂敏感且在 Wnt 反馈调节因子 RNF43 中携带突变,这意味着 RNF43 突变的结直肠癌(CRC)患者的一个亚群对该药物敏感。2017 年,Zhang 提出 CTC-类器官可用于预测 ALK 抑制剂 (ceritinib and crizotinib) 的治疗反应。综上,CTC-类器官可用于药物筛选,从而解决耐药和无效治疗的问题。
◆基因编辑
CRISPR/Cas9 技术自 2012 年以来已广泛应用于分子生物学的各个领域,CRISPR 与类器官结合在探索肿瘤的发生、异质性和转移方面具有不可或缺的作用。
◆肿瘤免疫治疗
近年来 CTLA-4 和 PD-1/PD-L1 等免疫治疗效果显著从而引发激烈的争论。Dijkstra 等将肿瘤类器官与外周血淋巴细胞一起培养并首次分离出肿瘤反应性 T 细胞,并评估 T 细胞介导的治疗效果,为晚期癌症患者带来光明前景。
7.CTC 与肿瘤转移
肿瘤细胞的活跃性和侵袭性启动了肿瘤的转移,具体过程如图所示。

◆主动迁移与被动扩散
活跃的肿瘤细胞可以自行移动,它们具有在细胞外基质中播种、破坏基底膜、穿透并逃脱血管壁的能力。主动的侵袭过程是基于细胞形态、位置和周围组织的改变,而被动传播是指癌细胞被外力拖拽或推离既定位置,可能的机制包括:1. 新生儿血管内皮细胞连接疏松,生长过程中出现肿瘤细胞渗漏;2. 被动地遵循其他肿瘤细胞蛋白水解的途径。
◆单个 CTC 与 CTC 簇
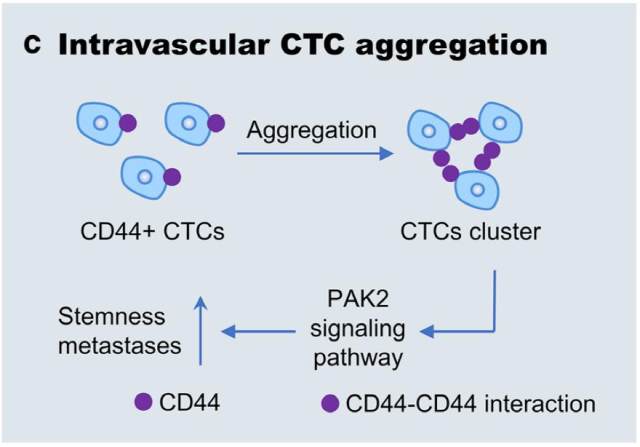
上皮-间质转化(EMT)被认为是引起肿瘤转移的途径,自 1976 年始,人们不断提出其他假说解释肿瘤转移。2014 年 Aceto 首次证实 CTC 簇由寡克隆肿瘤细胞群产生而不是聚集在血管中,CTC 簇数量比单个 CTC 少但转移能力是单个 CTC 的 23-50 倍,2019 年进一步发现 CTC 簇生物学特性与干细胞类似,并证实了乳腺癌 CTC 和 CTC 簇之间的 DNA 甲基化景观差异,并从 2486 个化合物中筛选出 Ouabain 可有效将 CTC 簇解离呈单细胞,使小鼠转移风险减少 80.7 倍。2016 年 Zhang 等发现在转移过程中癌细胞以两个分子不同、比例不同的亚群组成的内聚簇向远处器官转移。然而与 Aceto 和 Zhang 观点不同,Liu 提出 CTC 簇是由血管内单一肿瘤聚集形成的,而不是由共同迁移的细胞群形成的,并通过在不同时间向静脉注射癌细胞,证实了这一结果。研究人员还发现 CTC 簇聚集归因于 CD44 和 CD44-PAK2 相互作用(如图 c)。因此,以上 CTC 簇形成机制可能同时存在,明确具体哪一种占主导地位对抗转移治疗至关重要。此外,多种蛋白因子均参与了 CTC 的聚集,它们是单独调控还是协同调控肿瘤转移仍是未解。
8. 局限性与展望
尽管 CTC 检测具有非侵入性和动态监测的特点,但也存在一定的局限性。首先 CTC 非常罕见,在不同类型的肿瘤中差异很大,且不同检测方法的 CTC 阈值也不完全一致。针对这一问题,新兴的微芯片检测系统具有较高的分离效率和灵敏度。其次,对 CTC 的异质性和转移亚群的认知有限,目前已能够通过培养和单细胞分析进行 CTC 下游分析。CTC 分子表型和生物学特性可能有助于临床诊断和治疗,在未来可扩展到免疫检查点或疫苗治疗的免疫反应监测。最后,CTC 衍生的类器官也有应用局限,不能完全再现人体组织水平的相互作用,不能确定药物的器官毒性。然而,微流控技术可实现类器官与其他细胞如免疫细胞的共培养,模拟肿瘤微环境。
9. 结论
肿瘤转移起始于脱落到外周血的 CTC,因此靶向 CTC 的治疗可能减少转移。CTC 衍生的 3D 类器官保存有肿瘤的异质性和特性,可逐渐取代组织活检。综上,CTC 在临床诊断、预后评估 、治疗评价、疾病机制和药物开发等方面提供了新的维度和视野。
本文文献出处:
1. Yang C, Xia BR, Jin WL, Lou G. Circulating tumor cells in precision oncology: clinical applications in liquid biopsy and 3D organoid model. Cancer Cell Int. 2019 Dec 18;19:341. doi: 10.1186/s12935-019-1067-8. PMID: 31866766; PMCID: PMC6918690.
文章来源:芝友医疗
