研究简介
肺癌是世界上最常见的癌症之一,大多数患者诊断时即为晚期,约 70% 的新诊断患者为局部晚期或转移性疾病,具体可包括脑或中枢神经系统(CNS)转移 1。近年来脑转移(BM)的发生率正在增加,这可能与治疗的优化和生存延长相关 2。
脑部是肺癌常见的转移部位之一,约 17-65% 的原发性肺癌患者会发生脑转移 3。即使内脏转移得到控制,脑部也可能成为肿瘤生长的「安全港」,因为一般而言全身治疗药物通过血脑屏障的能力非常有限 4,5。
近年来随着对非小细胞肺癌(NSCLC)更深入的理解,引入了比传统化疗毒性更小的靶向治疗,这一进展彻底改变了 NSCLC 的治疗方式 6,7。EGFR 突变阳性患者中 BM 的发生率尚不清楚,但随着生存率的提高,BM 的发生率可能会增加 8。
本研究的目的是在真实世界中评估:伴或不伴 BM 的转移性 EGFR 突变阳性 NSCLC 患者的特征、症状负担、支持护理服务和临床结局,包括至治疗失败的时间(TTF)和总生存期(OS)。
研究设计
一项回顾性、观察、电子健康记录匹配队列研究,纳入 2014 年 1 月 1 日至 2016 年 7 月 31 日期间在美国肿瘤网络诊所接受治疗并随访至 2017 年 3 月 31 日的患者,入组患者诊断为 NSCLC 时>18 岁,确诊为 EGFR 突变阳性晚期转移性 NSCLC,研究期间至少随访 2 次。患者可伴有 BM,包括治疗前出现的和治疗后出现的。
研究结果
研究最终纳入 402 例患者,伴或不伴 BM 的各 201 人,白种人(69%),女性(65%)和腺癌(92%)的比例较高,有 75.1% 的患者初始诊断即为 IV 期。BM 患者初始诊断时年龄更大(中位年龄: 70 vs 77 岁;p = 0.0004),IV 期比例更高(81.6% vs 68.7%;p = 0.04)。
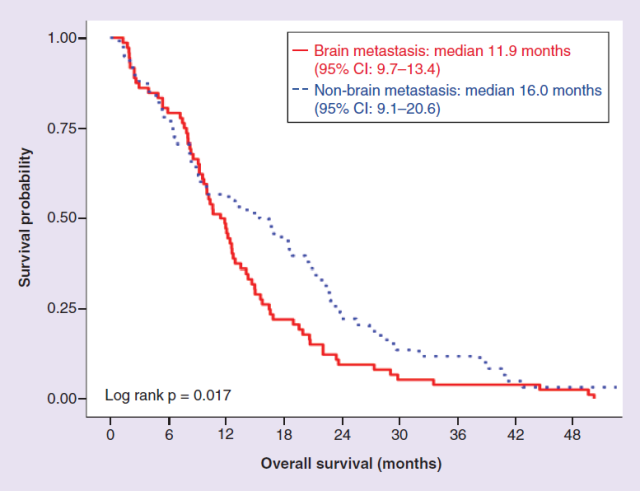
BM 患者的中位 OS 与无脑转移的患者相比明显缩短(11.9 个月 vs 16 个月;p = 0.017)
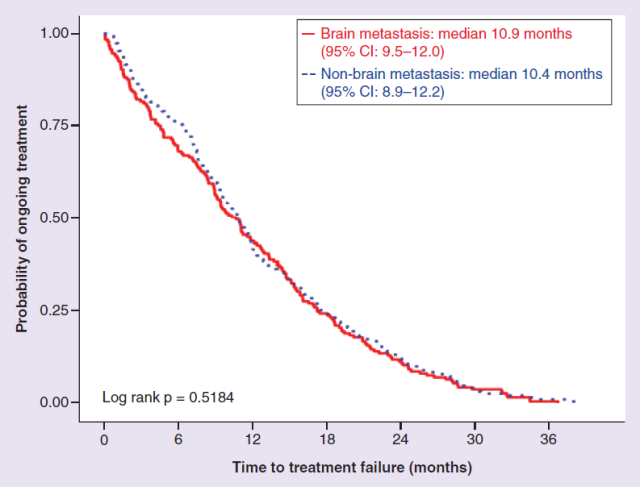
但伴或不伴 BM 的中位 TTF 时间无显著差异(10.9 个月 vs 10.4 个月;p = 0.5184)
研究结论
脑转移的治疗需要多学科协作,包括联合手术、放疗和/或可能穿透血脑屏障的全身治疗。越来越多的证据支持 EGFR-TKIs 在伴脑转移 NSCLC 患者中具有颅内活性。
一篇发表的综述评估了第一代 EGFR-TKI 吉非替尼和厄洛替尼的使用,在纳入该综述的 8 个 II 期临床研究中,未经选择的患者中颅内缓解率为 27-32%,与 EGFR 突变基因型相关的患者,如亚洲人,从不吸烟和腺癌患者中颅内缓解率为 43-74%,EGFR 突变阳性患者的颅内缓解率为 56-89%。
临床前研究显示了新一代 EGFR-TKIs 的中枢神经活性 9-12。奥希替尼是一种第三代不可逆的口服 EGFR-TKI,能够有效选择性地抑制 EGFR- TKI 敏感突变和 EGFR T790M 耐药突变。与其他 EGFR-TKIs 相比,奥希替尼已被证明可以在大脑中大量聚集 9,10。
在本研究中,大多数患者在进入研究时接受了第一代 EGFR-TKI 厄洛替尼一线治疗,没有患者接受第三代 EGFR-TKI 治疗,因为奥希替尼在研究过程中未获批准。III 期 FLAURA 研究比较了第三代 EGFR-TKI 奥希替尼和厄洛替尼/吉非替尼一线治疗 EGFRm+ 晚期 NSCLC 的疗效 13-15。在该试验中,大约 20% 的患者有 CNS 转移,与接受厄洛替尼或吉非替尼治疗的患者相比,接受奥希替尼治疗的患者的 CNS 进展风险更低(15% vs 6%)。FLAURA 的最终 OS 结果显示,与对照组 EGFR-TKI 相比,服用奥希替尼的患者的 OS 显著延长,死亡风险降低 20%(mOS 38.6 个月 vs 31.8 月,p = 0.046)16。
本研究的优势在于用丰富的真实临床数据,评估社区背景下伴或不伴脑转移的 EGFR 突变阳性晚期 NSCLC 患者的症状和预后。局限性包括本研究是回顾性、观察性研究,电子病历中可能出现的数据丢失和文档错误。研究数据表明,伴脑转移的 EGFR 突变阳性晚期转移性 NSCLC 的治疗需求尚未得到满足。考虑到治疗领域的最新进展,未来的研究应该探索新的靶向治疗,如第三代 EGFR-TKIs,如何影响这些患者的临床结果,以及第三代 EGFR-TKIs 广泛应用后,在现实世界中这些患者的临床结局如何变化。
审稿专家 
高俊珍 教授
内蒙古医科大学附属医院
内蒙古医科大学附属医院
呼吸与危重症医学科主任医师,研究生导师
内蒙古医学会结核分会常委
内蒙古医学会呼吸分会常委
内蒙古抗癌协会肺癌专业委员会委员
内蒙古抗癌协会化疗专业委员会委员
内蒙古抗癌协会肿瘤生物免疫治疗专委会常委
全国呼吸科肺癌协作组委员
中国早期肺癌诊治协作组委员
中国肺癌防治联盟全程管理委员会委员
全国基层肺癌诊治能力提升项目(「爱肺」计划)
专家工作组成员
中国康复医学会呼吸康复专业委员会重症康复学组委员
中国老年保健协会
肿瘤风险评估与系统干预专业委员会康复学组常委
北京肿瘤防治研究会常委
主持省部级科研课题 9 项
参编著作和教材 6 部及核心期刊发表论文多篇

王庆奎 教授
兴安盟人民医院
副主任医师
兴安盟人民医院呼吸与危重症医学二科主任
医务部副主任,感染管理科主任
中国医院协会医院感染管理专业委员会青年委员
内蒙古医学会呼吸分会委员
内蒙古睡眠医学会心理与睡眠专业委员会常委
内蒙古预防医学会感染控制委员会常委
内蒙古预防医学会感染控制委员会微生物与抗生素应用学组主任委员
兴安盟医学会医院感染控制分会主任委员
兴安盟呼吸专科联盟副主席,兴安盟科技专家库专家
内蒙古第四批援鄂医疗队队员
参考文献
1.Molina JR, Adjei AA, Jett JR. Advances in chemotherapy of non-small-cell lung cancer. Chest 130(4), 1211–1219 (2006).
2.Stanic K, Zwitter M, Hitij NT, Kern I, Sadikov A, Cufer T. Brain metastases in lung adenocarcinoma: impact of EGFR mutation status on incidence and survival. Radiol. Oncol. 48(2), 173–183 (2014).
3.Fox BD, Cheung VJ, Patel AJ, Suki D, Rao G. Epidemiology of metastatic brain tumors. Neurosurg. Clin. N. Am. 22(1), 1–6, v (2011).
4.Jamal-Hanjani M, Spicer J. Epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of epidermal growth factor receptor-mutant non-small-cell lung cancer metastatic to the brain. Clin. Cancer Res. 18, 938–944 (2012).
5.Wang BX, Ou W, Mao XY, Liu Z, Wu HQ, Wang SY. Impacts of EGFR mutation and EGFR-TKIs on incidence of brain metastases in advanced non-squamous NSCLC. Clin. Neurol. Neurosurg. 160, 96–100 (2017).
6.Gaughan E, Costa D. Genotype-driven therapies for non-small-cell lung cancer: focus on EGFR, KRAS and ALK gene abnormalities. Ther. Adv. Med. Oncol. 3, 335–348 (2011).
7.Cheng H, Xu X, Costa D, Al E. Molecular testing in lung cancer: the time is now. Curr. Oncol. Rep. 12, 335–348 (2010).
8.Fox BD, Cheung VJ, Patel AJ, Suki D, Rao G. Epidemiology of metastatic brain tumors. Neurosurg. Clin. N. Am. 22(1), 1–6, v (2011).
9.Colclough N, Ballard PG, Barton P et al. 64 – Preclinical comparison of the blood–brain barrier (BBB) permeability of osimertinib (AZD9291) with other irreversible next generation EGFR-TKIs. Eur. J. Cancer 69(Suppl. 1), S28 (2016).
10.Ballard P, Yates JW, Yang Z et al. Preclinical comparison of osimertinib with other EGFR-TKIs in EGFR-mutant NSCLC brain metastases models and early evidence of clinical brain metastases activity. Clin. Cancer Res. 22(20), 5130–5140 (2016).
11.Wu YL, Ahn MJ, Garassino MC et al. CNS efficacy of osimertinib in patients with T790M-positive advanced non-small-cell lung cancer: data from a randomized Phase III trial (AURA3). J. Clin. Oncol. 36(26), 2702–2709 (2018).
12.Reungwetwattana T, Nakagawa K, Cho BC et al. CNS response to osimertinib versus standard epidermal growth factor receptor tyrosine kinase inhibitors in patients with untreated EGFR-mutated advanced non-small-cell lung cancer. J. Clin. Oncol. 36(33), 3290–3297(2018).
13.Reungwetwattana T, Nakagawa K, Cho BC et al. CNS response to osimertinib versus standard epidermal growth factor receptor tyrosine kinase inhibitors in patients with untreated EGFR-mutated advanced non-small-cell lung cancer. J. Clin. Oncol. 36(33), 3290–3297(2018).
14.Soria JC, Ohe Y, Vansteenkiste J et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N. Engl. J. Med. 378(2), 113–125 (2018).
15.Ramalingam SS, Vansteenkiste J, Planchard D et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N. Engl. J. Med. 382(1), 41–50 (2020).
16.Li W, Zhao T, Xu H, Al E. The role of EGFR mutation as a prognostic factor in survival after diagnosis of brain metastasis in non-small-cell lung cancer: a systematic review and meta-analysis. BMC Cancer 19(1), 145 (2019).
CN-61739 Expiration Date: 14/08/2021
