达洛鲁胺是(Darolutamide,商品名:Nubeqa)是一种雄激素受体抑制剂。2019 年 7 月 30 日,美国 FDA 批准达洛鲁胺用于治疗非转移性去势抵抗性前列腺癌(NM-CRPC)。
达洛鲁胺批准是基于一项多中心、双盲、安慰剂对照三期临床试验——ARAMIS 研究。该试验纳入了 1509 例 NM-CRPC 患者。患者被随机分为两组,试验组入组 955 例患者,服用达洛鲁胺 600 mg/次,2 次/天;安慰剂组入组 554 例患者。所有患者同时接受一种促性腺激素释放激素(GnRH)类似物治疗或先前已切除双侧睾丸。
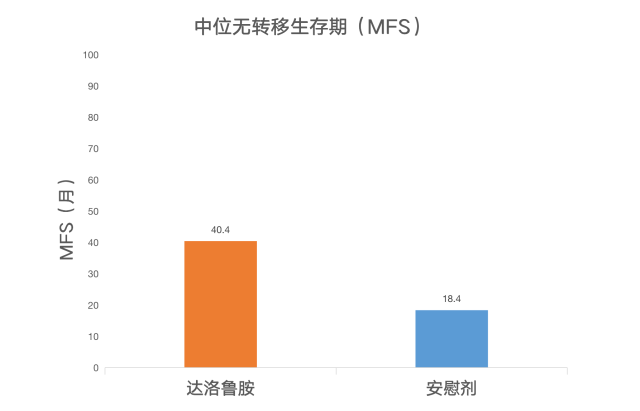
2019 年 3 月,Fizazi Karim 等研究者在 NEJM 上发表了该临床试验的初步结果 [1],即无转移生存期(MFS)。试验组患者的中位 MFS 为 40.4 个月,而安慰剂组患者为 18.4 个月,当时总生存期数据尚未完成统计。
近日,Fizazi Karim 等再次在 NEJM 上发表了该临床试验的最新结果 [2],研究终点包括总生存率(OS)、至疼痛进展的时间、至首次启动细胞毒性化疗药物时间以及至出现有症状骨相关事件的时间。
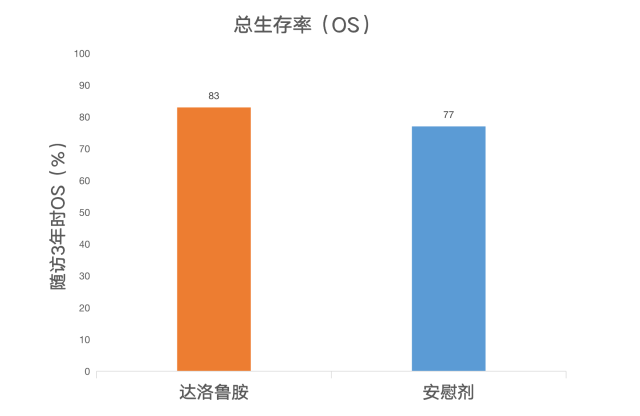
该 ARAMIS 临床试验中位随访时间为 29 个月,统计 OS 时该试验研究对象中死亡人数为 254 名 [达洛鲁胺组 148 名(15%)VS 安慰剂组 106 名(19%)]. 3 年随访时,达洛鲁胺 OS 为 83%,安慰剂组 OS 为 77%。达洛鲁胺组死亡风险降低了 31%(死亡风险比 0.69,p = 0.003)。
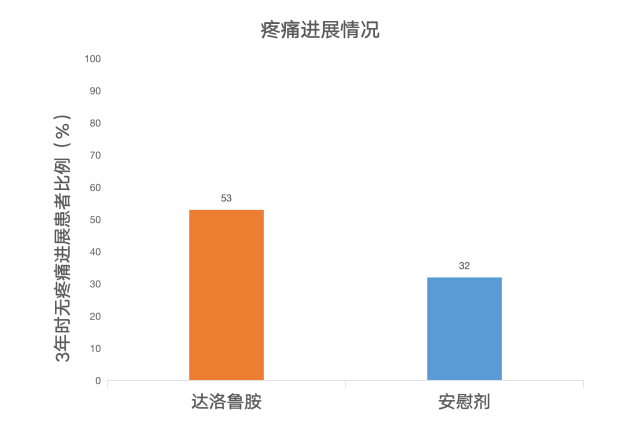
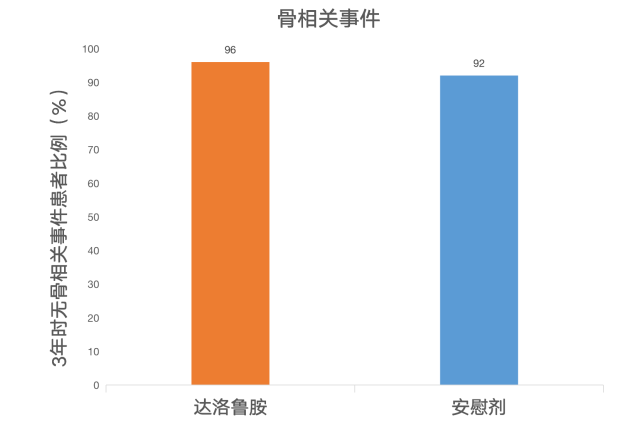
除此之外,相比安慰剂组,其他研究终点结果中,达洛鲁胺同时也表现出了其优势。其中,达洛鲁胺组患者至疼痛进展的时间、至启动第一种细胞化疗的时间以及至首次发生有症状的骨相关事件的时间均明显延长。
综合两次发表的 NEJM 文章,ARAMIS 研究的总体结果概括如下:

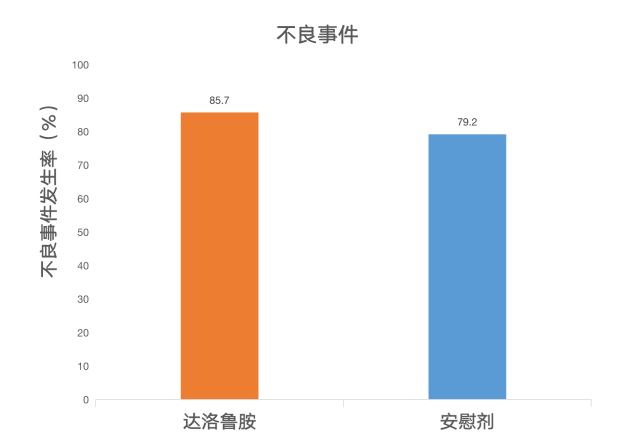
不良反应:达洛鲁胺最常见的不良反应(≥ 2%)是乏力、四肢疼痛和皮疹。达洛鲁胺试验组患者更常见缺血性心脏病(4.3%)和心力衰竭(2.1%)。两组的癫痫发作率相似(0.2%)。
用法用量:达洛鲁胺推荐剂量为 600 mg(两片,300 mg 片剂)/次,2 次/天,与食物同服。患者应同时接受一种促性腺激素释放激素(GnRH)类似物治疗或先前已切除双侧睾丸。
该文章最终得出的结论:非转移性去势抵抗性前列腺癌患者中,3 年随访时,达洛鲁胺胺组生存患者比例明显高于安慰剂组,两组不良事件发生率基本相似。
NM-CRPC 是指仅存在 PSA 持续升高且维持去势状态,但没有影像学检查可发现转移灶的前列腺癌患者,是进展为 CRPC 前的一种特殊阶段,该阶段的积极治疗有利于提高患者的总生存时间。既往已有研究证实,恩杂鲁胺、阿帕鲁胺适用于 NM-CRPC 的治疗。本文介绍的 ARAMIS 研究也证实达洛鲁胺能够延长 NM-CRPC 患者的无转移生存及总生存时间,作为新型抗雄激素内分泌治疗药物,给 CRPC 患者增添了新的治疗选择,具有良好的应用前景。
附:NM-CRPC 治疗相关药物及其临床试验

参考文献:
[1]Fizazi Karim,Shore Neal,Tammela Teuvo L et al. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer.[J] .N. Engl. J. Med., 2019, 380: 1235-1246.
[2]Fizazi Karim,Shore Neal,Tammela Teuvo L et al. Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide.[J] .N. Engl. J. Med., 2020, 383: 1040-1049.
