骨髓增殖性肿瘤(MPN)起源于造血干细胞,以一系或多系(粒系、红系、巨核系和肥大细胞系)血细胞持续过度增殖为特征。真性红细胞增多症(PV)和原发性血小板增多症(ET)均属于 MPN。这类患者临床表现相对隐匿,患者可无症状,也可出现乏力、头晕、腹胀、记忆力差、瘙痒、骨痛等多种症状,查体常可发现脾大。其主要并发症为血栓形成和出血,且具有转化为骨髓纤维化和急性白血病的风险。临床上患者多在体检时、或诊治其他疾病、发生血栓事件时才发现此病,既延误了治疗时机,也给患者带来了不可挽回的身体损害。目前对于 MPN 患者的一线降细胞治疗推荐羟基脲和干扰素 α(IFNα),年轻患者和孕妇群体推荐 IFNα。随着医患对远期疗效和安全性的追求,国内外以聚乙二醇干扰素 α(PEG IFNα)进行降细胞治疗的研究也越来越多。在最新 2019 年 NCCN 指南中,PEG IFNα 作为一线降细胞治疗推荐;2018 年 BSH 指南中,PEG IFNα 作为优先推荐。
1、权威指南对于 PV 和 ET 的诊疗建议
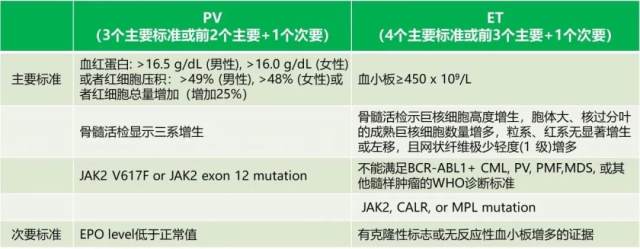
1.1 2019 NCCN 指南 [1]:PV 和 ET 的诊断标准:
PV 患者的主要诊断标准涉及血红蛋白计数/红细胞压积/红细胞总量、骨髓活检结果和基因突变情况,一个次要标准是促红细胞生成素(EPO)的水平低于正常值。
ET 患者的主要诊断标准涉及血小板计数、骨髓活检结果、排除其他髓样肿瘤的诊断标准以及基因突变情况,一个次要标准是有克隆性标志或无反应性血小板增多的证据。
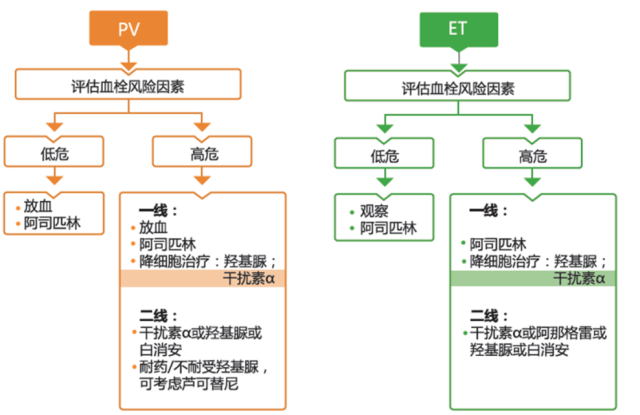
1.2 各大指南中 PV 和 ET 的推荐治疗方案
2015 ESMO(欧洲肿瘤内科学会)临床实践指南 [2] 中提出了对于羟基脲使用风险的担心。患者首先需评估血栓风险因素,若为高危患者,则在阿司匹林的基础上需加上降细胞治疗,一线降细胞治疗方案包括羟基脲和 IFNα。羟基脲作为目前广泛使用的口服化药,指南强调虽然目前无明确证据证实羟基脲的致白血病作用,但需注意风险可能会随着羟基脲的长期使用而出现,因此对于年轻患者,使用其他替代治疗(如 IFNα)更加合理。
2016 中国专家共识 [3,4] 也考虑到羟基脲的风险:虽然对于 PV 和 ET 患者均推荐羟基脲和 IFNα,但在年轻患者和妊娠期的患者则更推荐用 IFNα。
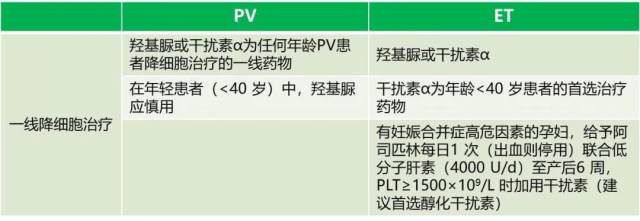
2018 年 BSH 指南 [5] 中将 PEG IFNα 作为优先推荐(IA)。
2019 NCCN 指南(V3.0)[1] 中也明确建议:在高危 PV 或 ET 患者中,对于年轻患者和妊娠期患者采用普通 IFNα 或 PEG IFNα 进行降细胞治疗。
2、药代动力学分析和临床研究证实:PEG IFNα 比普通 IFNα 疗效更佳
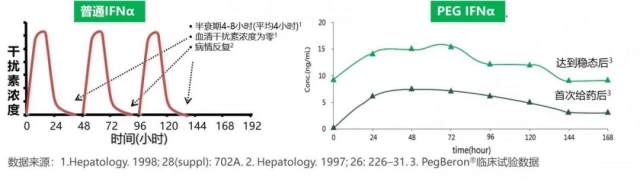
普通 IFNα 半衰期短,血药物浓度波动大,需隔天注射一次,患者使用不便,疗效不能充分保障。
PEG IFNα 经过聚乙二醇化修饰后,药代动力学参数改变,血药浓度平稳,有效药物浓度可持续一周,药物作用效果得到保障。因此可持续发挥抗肿瘤作用,也增强了患者依从性。
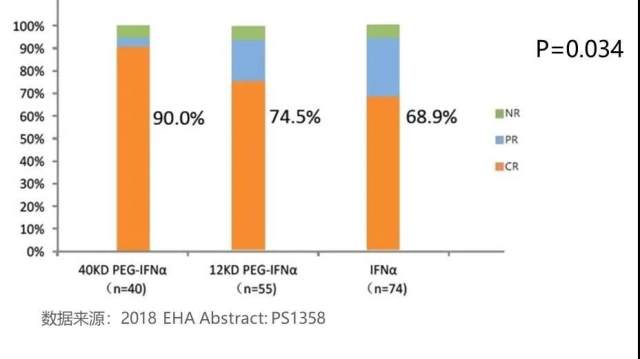
在 2018 EHA 摘要中,一项研究对比了 PEG IFNα 与 IFNα 治疗 ET 患者的疗效,PEG IFNα 组完全缓解(CR)率显著优于 IFNα 组(P = 0.034),其中 40kD PEG IFNα 优于 12kD PEG IFNα, 安全性方面 PEG IFNα 组更佳。
3、PEG IFNα 抑制恶性克隆,显著降低基因突变负荷,诱导高分子学缓解
3.1 JAK2 突变负荷增加 MPN 患者的相关危险因素
有研究显示,PV 患者高的 JAK2(V617F) 突变负荷与骨髓纤维化的进展程度、更严重的脾肿大和更高的白细胞计数有关,并且会增加血栓形成的概率 [6]。
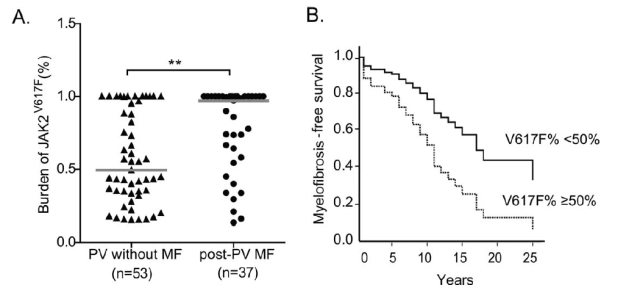
一项入组 272 例中国 JAK2 突变 PV 患者的研究结果表明:post-PV MF 患者的中位 JAK2 突变负荷比无骨髓纤维化 PV 患者的明显更高(96.99% vs 43.80%,P<0.01),且 JAK2 突变负荷低的 PV 患者无纤维化生存明显更长 ( P = 0.017)[7]。
并且研究发现造血干细胞移植后 6 个月,JAK2 突变阳性的患者复发率显著高于 JAK2 突变阴性的患者(P = 0.03)[8]。
由此可见,在 MPN 患者治疗时应关注患者的 JAK2 突变负荷,以指导治疗方案的选择。
3.2 PEG IFNα 可诱导高分子学缓解率
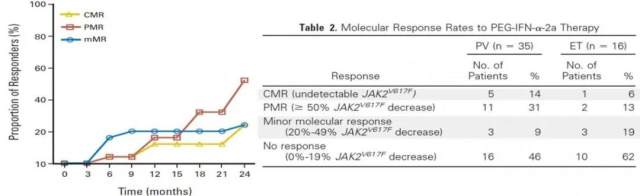
有研究显示:在晚期 ET 或 PV 患者中,PEG IFNα 治疗可诱导较高的分子学缓解率 [9]。PEG IFNα 治疗 24 个月,ET 患者和 PV 患者的分子学缓解率分别达 38% 和 54%,其中完全分子学缓解(JAK2V617F 突变转阴)率分别为 6% 和 14%。PV 患者治疗 24 个月,JAK2V617F 突变负荷从 64% 降至 12.2%。获得有意义的分子学缓解至少要用药后 6 个月。
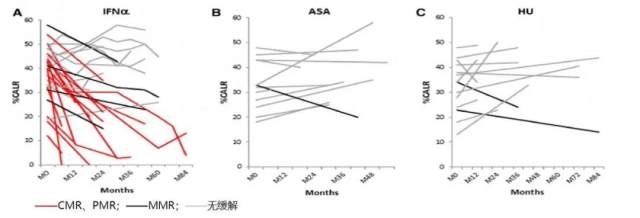
2013 年发表在 Blood 上的一项研究也发现类似的结果 [10],中位随访 42 个月,PEG IFNα 治疗的 PV 和 ET 患者分子学缓解率分别为 61% 和 67%,完全分子学缓解率分别为 18% 和 17%。2019 年发表的最新研究也显示:对于 HU 耐药或者不耐受的 PV 患者接受 PEG IFNα 治疗同样可以获得高的分子学缓解率 [11]。
另外,一项关于只有 CALR 突变的 ET 患者的研究显示只有接受 PEG IFNα 治疗的患者才可获得分子学缓解,CALR 突变负荷从治疗前的 41% 下降到 26%,其中 2 例患者实现完全分子学缓解 [12]。因此 PEG-IFNα 不仅可诱导 JAK2 突变负荷显著下降,还对 CALR 突变负荷有明显的作用,可有效抑制 MPN 的恶性克隆。
4、小结
对于 MPN 患者的治疗,权威指南推荐 PEG IFNα 作为一线降细胞治疗方案或作为优先推荐。目前药代动力学分析和临床研究证实:PEG IFNα 比普通 IFNα 疗效更佳。MPN 患者 JAK2 突变负荷会增加相关危险因素,因此降低 JAK2 突变负荷对 MPN 患者有重要意义。而越来越多研究发现 PEG IFNα 抑制恶性克隆,可显著降低 MPN 患者的基因突变负荷,甚至使其转阴,这是 PEG IFNα 治疗 MPN 患者的一个无可替代的优势。下一期,我们将详细介绍 PEG IFNα 治疗 MPN 患者的研究进展。
参考文献:
[1] NCCN Guidelines Version 3.2019 Myeloproliferative Neoplasms[J]. 2019.
[2] Vannucchi AM, Barbui T, Cervantes F, et al. Philadelphia chromosome-negative chronic myeloproliferative neoplasms: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2015, 26 Suppl 5: v85-99.
[3] 肖志坚. 真性红细胞增多症诊断与治疗中国专家共识 (2016 年版)[J]. 中华血液学杂志, 2016, 37(04): 265-268.
[4] 肖志坚. 原发性血小板增多症诊断与治疗中国专家共识 (2016 年版)[J]. 中华血液学杂志, 2016, 37(10): 833-836.
[5] McMullin MF, Harrison CN, Ali S, et al. A guideline for the diagnosis and management of polycythaemia vera. A British Society for Haematology Guideline[J]. Br J Haematol, 2019, 184(2): 176-191.
[6] Silver RT, Vandris K, Wang YL, et al. JAK2(V617F) allele burden in polycythemia vera correlates with grade of myelofibrosis, but is not substantially affected by therapy[J]. Leuk Res, 2011, 35(2): 177-182.
[7] Bai J, Ai L, Zhang L, et al. Incidence and risk factors for myelofibrotic transformation among 272 Chinese patients with JAK2-mutated polycythemia vera[J]. Am J Hematol, 2015, 90(12): 1116-1121.
[8] Alchalby H, Badbaran A, Zabelina T, et al. Impact of JAK2V617F mutation status, allele burden, and clearance after allogeneic stem cell transplantation for myelofibrosis[J]. Blood, 2010, 116(18): 3572-3581.
[9] Quintas-Cardama A, Kantarjian H, Manshouri T, et al. Pegylated interferon alfa-2a yields high rates of hematologic and molecular response in patients with advanced essential thrombocythemia and polycythemia vera[J]. J Clin Oncol, 2009, 27(32): 5418-5424.
[10] Quintas-Cardama A, Abdel-Wahab O, Manshouri T, et al. Molecular analysis of patients with polycythemia vera or essential thrombocythemia receiving pegylated interferon alpha-2a[J]. Blood, 2013, 122(6): 893-901.
[11] Yacoub A, Mascarenhas J, Kosiorek H, et al. Pegylated interferon alfa-2a for polycythemia vera or essential thrombocythemia resistant or intolerant to hydroxyurea[J]. Blood, 2019, 134(18): 1498-1509.
[12] Verger E, Cassinat B, Chauveau A, et al. Clinical and molecular response to interferon-alpha therapy in essential thrombocythemia patients with CALR mutations[J]. Blood, 2015, 126(24): 2585-2591.
图片来源:特宝
