2020 年 5 月 29 日,在深圳华大基因股份有限公司 (以下简称华大基因,股票代码 300676.SZ) 召开的「全景测序 防癌控癌——2020 华大基因肿瘤技术成果研讨与发布会」上,华大基因在线发布了三款肿瘤检测技术:基于甲基化快速靶向测序 EpiPlexTM 的肝癌早检技术 、同源重组缺陷 (HRD) 检测技术(GSA)、实体瘤患者定制化监测技术(Signatera),助力肿瘤的筛、诊、监的全景防控。
复旦大学附属中山医院副院长、肝脏外科主任周俭教授、复旦大学附属肿瘤医院妇科主任吴小华教授,共同担任此次大会主席;北京协和医院妇科主任医师吴鸣教授、复旦大学附属肿瘤医院大肠外科主任医师彭俊杰教授、华大基因肿瘤事业部负责人朱师达博士、华大数极生物科技(深圳)有限公司首席技术官汪宇盈博士、华大基因肿瘤研发技术负责人吴惠子博士分别分享了关于卵巢癌、肠癌、肝癌三个方向的国内外研究、临床治疗进展,及 3 款华大基因最新肿瘤检测技术。华大基因大众传播部总监项飞主持了此次大会。

恶性肿瘤(癌症)已经成为严重威胁中国人群健康的主要公共卫生问题之一。癌症预防分为三级,一级预防是病因预防,远离致癌危险因素,减少发病机率。二级预防是对癌症早发现,早诊断;三级预防是临床标准化治疗和康复治疗,改善癌症患者的预后和生活质量。朱师达博士表示,华大基因坚持在肿瘤基础科研和临床应用方面不断探索,在精准肿瘤领域持续发力,此次发布的三款技术正是应对肿瘤的早期诊断、用药指导、复发监测,助力肿瘤的全景防控。
技术 1:寻癌变因子特征信号——基于甲基化高深度靶向测序的肝癌早检技术
中国是一个肝癌大国。据统计,中国每年新增的肝癌患者约 37 万 [1],约占全球新增肝癌患者的一半(95 万)[2]。肝癌是一种隐匿性发病的癌症,早期临床症状多不明显,但是病情进展迅速,整体五年生存率仅有 18%。对肝癌高危人群的筛查和监控,有助于肝癌早发现、早诊断、早治疗,是提高肝癌患者治疗效果和生存率的关键。目前临床常用的肝癌筛查手段是血清甲胎蛋白(AFP)检测联合肝脏超声检查,在一定程度上能够有效的降低肝癌死亡率,但对早期肝癌的灵敏度和特异性不太理想(AFP 检测灵敏度 25-65%,特异性 80-94%;超声检查灵敏度 51-78%,特异性 80-100%)[3],限制了其在肝癌早筛早诊方面的应用价值。
近年来, 肿瘤细胞坏死或凋亡过程中释放至外周血中的 DNA(Circulating tumor DNA,ctDNA)的发现为癌症液体活检技术的发展提供了基础,同时也为癌症早筛和早诊提供了新的思路和方向。但是,ctDNA 的信号常常淹没在大量游离 DNA(cell-free DNA,cfDNA)的背景中,因此,高效的新型检测技术的开发和有效的分子标志物的发现十分关键。
此次发布的由华大基因旗下子公司华大数极生物科技(深圳)有限公司(以下简称「华大数极」)开发的新型肝癌早检技术,通过数极自主研发的甲基化快速靶向建库测序技术(EpiPlexTM),对血液中游离 DNA 中肝癌特异性 CpG 位点的甲基化状态进行单碱基分辨率的定量检测。会上,华大数极首席技术官汪宇盈博士公开了多中心临床试验数据,结果表明该技术对早期肝癌的检测能达到 89.5% 灵敏度和 93.7% 的特异性。接下来,华大数极将进一步扩大临床验证规模,并计划开展前瞻性队列研究以评估该技术的临床应用价值。

技术 2:探基因组瘢痕奥秘——同源重组缺陷 (HRD) 检测技术(GSA)
国家癌症中心发布的中国 2019 最新癌症统计数据表明,中国每年卵巢癌新发病例约为 5.21 万例,每年因卵巢癌死亡约 2.25 万例 [1],由于大多数卵巢癌患者发现已经是晚期,并且 5 年生存率不足 30%,因此卵巢癌已经成为女性最致命的恶性肿瘤之一。
卵巢癌的精准靶向治疗相对于其它肿瘤来说起步较晚,但随着 PARP 抑制剂的问世给卵巢癌患者带来了新的希望。2014 年第一款 PARP 抑制剂奥拉帕利被 FDA 批准用于胚系 BRCA 基因突变的晚期卵巢癌患者。随后又有多个 PARP 抑制剂陆续获批上市,极大地延长了卵巢癌患者的无铂间期,提高了生存获益,带领卵巢癌治疗真正迈进了精准维持治疗时代。今年 5 月 11 日,FDA 批准了奥拉帕利联合贝伐珠单抗用于 HRD 阳性人群一线维持治疗的适应症。卵巢癌 PARP 抑制剂生物标记物从 BRCA 基因拓展到了 HRD 状态,这是一个质的飞跃,意味着获益人群将从 20% 左右扩展到大约 50% 以上。
华大基因肿瘤事业部负责人朱师达博士提到,根据目前国内外公认的 HRD 检测方法--- Genomic Scar 法,华大基因基于中国人群的遗传多态性数据,设计了一个涵盖数十万个单核苷酸多态性(SNP)位点,能够覆盖整个基因组的 panel,并自主研发 GSA(Genomic Scar Analysis)分析流程。该流程通过评估基因组杂合性缺失(Loss of heterozygosity,LOH)、端粒等位基因失平衡(Telomeric allelic imbalance,TAI)和大片段迁移(Large-scale state transitions,LST)这三项指标计算 HRD score,评估同源重组缺陷状态。

朱师达博士还提到,GSA 技术中至关重要的一个环节就是肿瘤纯度和倍性的校正。因为肿瘤细胞易发生染色体变异(即非整倍性),这种现象可在多个癌种患者的肿瘤细胞中都存在,其原因可能是由于肿瘤细胞中与有丝分裂相关的基因发生了突变,使染色体发生不均等分离,从而导致检测出较多的 CNV[4]。因此,在进行 HRD 检测分析过程中,需要针对个体患者进行肿瘤纯度和倍性的校正,使检测结果更能真实反映患者的同源重组缺陷状态,华大基因针对该环节进行了相关验证,充分证实了华大自主开发 GSA 技术的科学性与准确性。
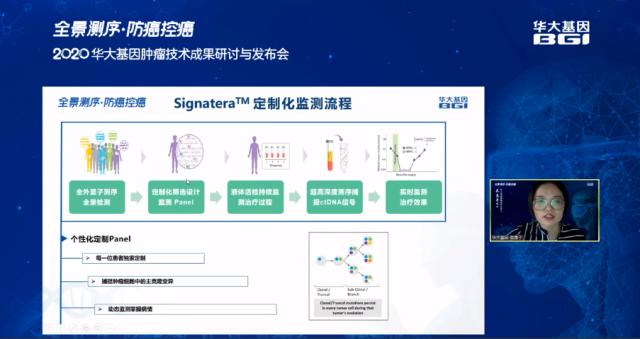
技术 3:察动态分子残留——实体瘤患者定制化监测技术(Signatera)
随着科技和现有医疗技术的进步,癌症治疗越来越趋向于精准化治疗,大部分患者能够带瘤生存。据统计,2015 年之后,中国癌症患者的 5 年生存率为 36.9% [5]。针对这部分患者, 急需一种长期有效的临床手段对其疾病进展进行动态监测。然而,现有的监测方式,如肿瘤标志物、CT 扫描、核磁共振成像(MRI)、断层扫描成像(PET)、钼靶 X 线和 X-光等,存在一定的局限性,特异性或敏感性较差,用于疗效评估和复发监测临床效果欠佳,往往会使患者错失最佳治疗时机。尤其是采用新型疗法的患者,很难用传统的影像学方法准确评估其疾病进展,如接受免疫治疗的肿瘤患者中有 2%-8% 被报道存在假进展 [6]。而 ctDNA 半衰期短,敏感性高,能够及时反映肿瘤的动态变化,并且与常见肿瘤标志物相比,ctDNA 监测反映的疾病进展与阳性影像结果具有更好的一致性 [7]。
华大基因与美国 Natera 公司强强联合,开发了基于 DNBSEQ 测序原理的、针对实体瘤患者定制化监测的 Signatera 技术。该技术通过全外显子测序技术(WES)对肿瘤组织和配对血细胞进行全景检测,然后结合超高深度液体活检对患者的疾病进行动态监测,特定位点的有效测序深度超过 30,000X,能有效检测频率 < 0.1% 的体细胞突变 [9-10], 具有高达 99.5% 的临床特异性 [8-12],做到更早、更精准的预测肿瘤复发和疾病进展。
华大基因吴博士表示,在结直肠癌、乳腺癌、非小细胞肺癌和膀胱癌的临床试验中,该技术相比影像学和肿瘤标志物检测,最早可提前 24 个月提示患者临床复发 [10-13]。Signatera 技术不仅能够检测术后 MRD 状态,还能全程监测患者 ctDNA 动态变化,精准预测疾病进展,提早防范肿瘤复发,为医生调整治疗方案提供参考,也为患者接受最合适的治疗争取有效的窗口期。
复旦大学附属中山医院副院长、肝脏外科主任周俭教授:由于疫情的关系,医疗和公共卫生成为了今年两会的热门议题之一。在今年的《政府工作报告》提到要实施癌症防治行动,推进预防筛查、早诊早治和科研攻关,着力缓解民生的痛点。肝癌在我国癌症发病率中排第四位,死亡率排第二位,疾病负担重。如何建立肝癌早检新技术、研发转移复发预警新方案、克服肝癌异质性制定个体化治疗新策略,一直是我们中山医院致力探索的方向。今天也很荣幸展示我们跟华大基因合作研发的甲基化液体活检技术的成果,该技术可以高敏地检测血液中游离 DNA 中肝癌特异性的、表观基因组层面的异常信号,从而实现对早期肝癌的无创检测;其检测性能显著优于传统的肿瘤标志物。此外,我们也跟华大基因在实体瘤患者的定制化监测技术展开了临床合作。该技术针对肿瘤的患者治疗期和治疗后进行全程监测,具有非常广泛的临床应用场景和很高的临床特应性和灵敏性。同时,我也了解到这个技术在 Nature, Jama oncology, JCO 等杂志发表了数据,有比较坚实的临床数据显示其能比现有的影像学和肿瘤标志物提前提示患者的临床复发。我们期待,这些新技术能帮助推动中国癌症患者的临床诊疗方案进步,为中国的癌症患者带来福音。
复旦大学附属肿瘤医院妇科主任吴小华教授:去年 10 月,FDA 批准了尼拉帕利用于 HRD 阳性的三线或三线以上卵巢癌患者的维持治疗;今年 5 月,FDA 批准了奥拉帕利联合贝伐珠单抗用于 HRD 阳性的卵巢癌患者的一线维持治疗。并且,今年最新公布的 2020 年 V1 版卵巢癌 NCCN 指南中提到,如果 BRCA1/2 基因检测结果为阴性,HRD 阳性可以作为 PARP 抑制剂一线维持治疗的 2B 级证据。但是,目前国内还没有成熟的 HRD 检测技术。如果能够有一个基于中国人群的多态性特征来检测 HRD 的技术,这对于国内卵巢癌的精准诊治也是一个推进,会给更多的患者带来获益。我们跟华大合作开展了 HRD 的临床检测项目,取得了较好的阶段性成果。希望华大能够探索到更适合中国人群的 HRD 检测方法,并且这个方法是经过中国人群测试和验证的,客观反映中国人群的 HRD 状态,在临床上能够给患者带来更多的获益。
北京协和医院妇科主任医师吴鸣教授:近期公布的一些临床试验数据来看,像 PAOLA-1、PRIMA 临床数据表明,除了 BRCA1/2 阳性的卵巢癌患者,HRD 阳性也可以从 PARP 抑制剂的临床治疗中获益。并且今年最新公布的 2020 年 V1 版卵巢癌 NCCN 指南中提到,如果 BRCA1/2 基因检测结果为阴性,HRD 阳性可以作为 PARP 抑制剂一线维持治疗的证据。这说明 HRD 检测对卵巢癌患者有重要的临床指导意义。很高兴看到华大基因在这方面已经取得了很好的成果,期待这款技术为患者带来更多的获益。

复旦大学附属肿瘤医院大肠外科主任医师彭俊杰教授:对于早期肠癌,主要依靠外科手术进行治疗;对于 II、III 期肠癌,通常经分层治疗筛选高危患者接受辅助化疗;对于相对低危的患者,可以对患者进行观察、随访或建议患者参加临床研究。对于 IV 期肠癌则是通过放化疗、靶向治疗、手术治疗等多种方案综合进行治疗。 ctDNA 作为液态活检的重要部分,也是精准医疗时代重要的武器,适合作为分子标志物。ctDNA 的主要应用包含:早期诊断、分子分型、检测微小残留病灶、治疗疗效的动态监测等方面,其检测结果为临床决策提供依据。从临床实践也可以看到,每一个肠癌患者的特征是不一样的。很高兴看到华大基因用 WES 结合 ctDNA 监测的方法,为每一个患者提供独特的监测 Panel,真正地迈向个体化医疗。
华大基因将秉持「基因科技造福人类」的使命,继续发挥自身在基因科技领域的优势,研发更多国际领先的技术,为精准肿瘤诊治提供全面解决方案,让更多医生和患者通过先进技术获益,为「健康中国 2030」贡献坚实的自主科技力量助力。
专业名词解释:
灵敏度(Sensitivity,也称为真阳性率)是指实际为阳性的样本中,判断为阳性的比例(例如真正患病人群中,被医院判断为有疾病者的比例)
特异度(Specificity,也称为真阴性率)是指实际为阴性的样本中,判断为阴性的比例(例如真正没有疾病的人群中,被医院判断为没有疾病者的比例)
DNA 甲基化:DNA 化学修饰的一种形式,能在不改变 DNA 序列的前提下,改变遗传表现。为外遗传编码的一部分,是一种外遗传机制。研究表明,癌症的发生发展与 DNA 甲基化变异引起的基因表达调控异常有密切的联系。
数据来源:
[1]《国家癌症中心: 中国 2019 癌症统计数据》
[2] Fitzmaurice C, Abate D, et al. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-Years for 29 Cancer Groups, 1990 to 2017: A Systematic Analysis for the Global Burden of Disease Study. JAMA Oncol. 2019;5(12):1749‐1768.
[3] Ayoub WS, Steggerda J, Yang JD, Kuo A, Sundaram V, Lu SC. Current status of hepatocellular carcinoma detection: screening strategies and novel biomarkers. Ther Adv Med Oncol. 2019;11(Special Collection):1-14.
[4] Feng, R., Zong, Y., Cao, S. et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?. Cancer Commun 39, 22 (2019). https://doi.org/10.1186/s40880-019-0368-6」
[5] CA Cancer J Clin. 2016 Mar-Apr;66(2):115-32. doi: 10.3322/caac.21338. Epub 2016 Jan 25.
[6] BorcomanE, NandikollaA, Long G, Goel S, Le Tourneau C. Patterns of response and progression to immunotherapy. In: ASCO Educational Book.Chicago, IL: American Society of Clinical Oncology; 2018.
[7] SEN,S. Aneuploidy and cancer[J]. current opinion in oncology, 2000, 12(1):82.
[8]LanmanRB, Mortimer SA, ZillOA, et al. Analytical and clinical validation of a digital sequencing panel for quantitative, highly accurate evaluation of cell-free circulating tumor DNA. PLoSOne. 2015;10(10):e0140712. doi: 10.1371/journal.pone.0140712.
[9]PlagnolV, Woodhouse S, HowarthK, et al. Analytical validation of a next generation sequencing liquid biopsy assay for high sensitivity broad molecular profiling. PLoSOne. 2018;13(3):e0193802. doi: 10.1371/journal. pone.0193802.
[10]Stetson D, Ahmed A, Xu X, et al. Orthogonal comparison of four plasma NGS tests with tumor suggests technical factors are a major source of assay discordance. JCO Precision Oncology. 2019;3:1-9. doi: 10.1200/PO.18.00191.
[11]SethiH, SalariR, SwenertonR, et al. Analytical validation of the Signatera™ RUO assay, a highly sensitive patient-specific multiplex PCR NGS-based non-invasive cancer recurrence detection and therapy monitoring assay. In: Proceedings from the AACR Annual Meeting; April 14-18, 2018; Chicago, IL.Abstract 4542.
[12]Reinert T, Henriksen TV, Christensen E, et al. Analysis of plasma cell-free DNA by ultradeep sequencing in patients with stages I to III colorectal cancer [published online ahead of print May 9, 2019]. JAMA Oncol. 2019. doi:10.1001/jamaoncol.2019.0528.
[13]Christensen E, Birkenskamp-DemtroderK, SethiH, et al. Early detection of metastatic relapse and monitoring of therapeutic efficacy by ultra-deep sequencing of plasma cell-free DNA in patients with urothelial bladder carcinoma [published online ahead of print May 6, 2019]. J Clin Oncol. 2019. doi: 10.1200/JCO.18.02052.
图片来源:华大基因
