2020 年 1 月 7 日,由武汉华大吉诺因生物科技有限公司(以下简称「华大吉诺因」)和深圳吉诺因生物科技有限公司共同提交的治疗用创新生物制品「靶向新生抗原自体免疫 T 细胞注射液」(简称 Neo-T 注射液)临床试验申请(简称 IND 申请),获得了国家药品监督管理局的临床试验默示许可(受理号:CXSL1900109)。
这不仅标志着基于基因组学的个性化精准治疗获得了国家药监局的认可,在国内首次迈入注册临床试验阶段,也标志着在该领域我国已跻身国际前沿位置与欧美并跑。
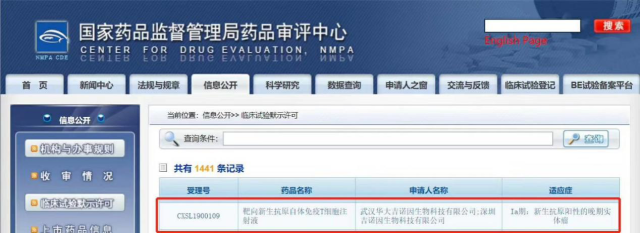
Neo-T 注射液是国内首个获得国家药监局临床试验默示许可的肿瘤新生抗原细胞治疗药物,也是华大吉诺因自主开发的首个申报国家药监局的产品。该产品 IND 申请于 2019 年 9 月 29 日获得国家药监局正式受理,历时仅 3 个多月,就获得了国家药监局的临床默示许可。这充分说明了该产品具有独特的临床价值和创新性,因此才能在多次沟通的基础上,快速通过国家药监局药品审评中心的技术审评,进入临床阶段。
相较于正常细胞,肿瘤细胞通常携带大量突变,并依赖突变获得生长优势或耐药特征。不同病人肿瘤组织所携带的突变不尽相同,限制了普适性肿瘤药物的研发和疗效。华大吉诺因自主研发的肿瘤治疗药物 Neo-T 注射液,针对每个患者进行个性化量身制备。
首先通过对患者肿瘤组织的高深度基因测序,检测患者的肿瘤突变,再利用自主开发的 EPIP 软件,鉴定这些突变所对应的肿瘤新生抗原,然后在符合 GMP(药品生产质量管理规范)要求的细胞制备车间,利用个性化肿瘤新生抗原诱导扩培出靶向肿瘤组织的免疫细胞制剂,回输给肿瘤患者,以达到杀伤肿瘤细胞的目的。
华大吉诺因在武汉光谷生物医药园建有符合 GMP 要求的细胞制备中心,总面积达 1000 余平米,拥有 9 条符合无菌制剂生产制备要求的独立细胞制剂生产线,以及专业化的细胞制剂生产和检测团队。同时,华大吉诺因自主开发的 EPIP 软件,在国际肿瘤新生抗原领域专业大赛中表现优异,其肿瘤新生抗原鉴定准确性名列前矛。
针对目前业界普遍存在的肿瘤新生抗原预测准确低、细胞生成水平参差不齐、细胞制剂长期存储稳定性难以保障等技术难题,华大吉诺因团队经过多年的潜心研究,开发了具备自主知识产权的软件包、免疫细胞生产工艺、冻存液保护剂等,可实现高质量、低成本、高效率的生产运营和技术服务提供。在获得一系列研究结果基础上提交 IND 申请,并获得国家药监局的临床试验默认许可。吉诺因研发的肿瘤新生抗原类药物也是华大集团在个性化精准治疗方面的新探索。
华大吉诺因 CEO 李波表示:「肿瘤新生抗原类药物代表着肿瘤治疗的一个新的方向,本次申报获得临床试验默示许可标志着个性化精准治疗在国内首次迈入临床阶段;我们将秉承基因科技造福人类的使命,通过不断的研究和积累,一步步实现将癌症变成慢性病、将更高效的癌症治疗药物服务于民的愿望。」 李波感谢了两年来政府各级领导的支持和团队的拼搏努力,同时也表示,Neo-T 注射液进入临床阶段,对于吉诺因意味着更大的责任和挑战。吉诺因将不忘初心,迎接挑战,再创佳绩。
华大吉诺因为深圳华大基因科技有限公司控股子公司,是一家致力于肿瘤免疫细胞治疗的高新生物科技企业。该公司通过利用先进的生命数字化技术,全方位激发人体免疫系统对抗肿瘤的活力,开发靶向肿瘤特异抗原的全新先进预防与治疗方案,使病人从中获益。从 2011 年开始,公司着力于肿瘤基因组、生物信息技术和肿瘤免疫的研发,累计发表国际高水平文章 33 篇。
图片来源:国家药品监督管理局药品审评中心
