2019 年 11 月 6 日,中国国家药品监督管理局(NMPA)官网显示默沙东公司旗下免疫检查点抑制剂帕博利珠单抗(俗称 K 药)的又一适应证审批状态从「在审评审批中」转为「在审批」[1],提示该适应证(受理号:JXSS1800025)审批已完成技术审评,进入行政审批阶段,有望在本月底正式获批。

据悉,此次获批的适应证为其联合化疗(卡铂联合紫杉醇)方案治疗一线转移性鳞状非小细胞肺癌(肺鳞癌),无论 PD-L1 表达状态。
帕博利珠单抗(K 药)已分别于 2018 年 7 月,2019 年 3 月以及 2019 年 9 月在国内获批治疗不可切除的转移性黑色素瘤、联合化疗一线治疗非鳞 NSCLC,以及单药一线治疗 PD-L1 表达阳性(TPS ≥ 1%)NSCLC(包括鳞和非鳞 NSCLC)的适应证。此次适应证的获批将是 K 药在华获批的第四个适应证,也将是其获批的第三个一线治疗 NSCLC 的适应证。K 药目前已是国内获批适应证最多的 PD-1 单抗。
一旦 K 药一线治疗肺鳞癌适应证获批,这标志着我国免疫一线治疗 NSCLC 将与欧美和日本同步,国内医生手中握有的可选择的免疫一线治疗晚期 NSCLC 的方案数量将与欧美日国家的医生等同。
当前仅有 K 药和罗氏的 Tecentriq(T 药)在美国、欧盟和日本获批一线治疗 NSCLC 适应症。若 K 药治疗肺鳞癌适应证在国内获批,其获批一线治疗 NSCLC 适应证数量(3 个)将超越欧盟(2 个),与美国和日本获批数量持平(看下图)。 T 药在日本(1 个)、美国(1 个)和欧盟(2 个)皆仅获批一线治疗非鳞 NSCLC,在国内尚未获批任何治疗适应证。
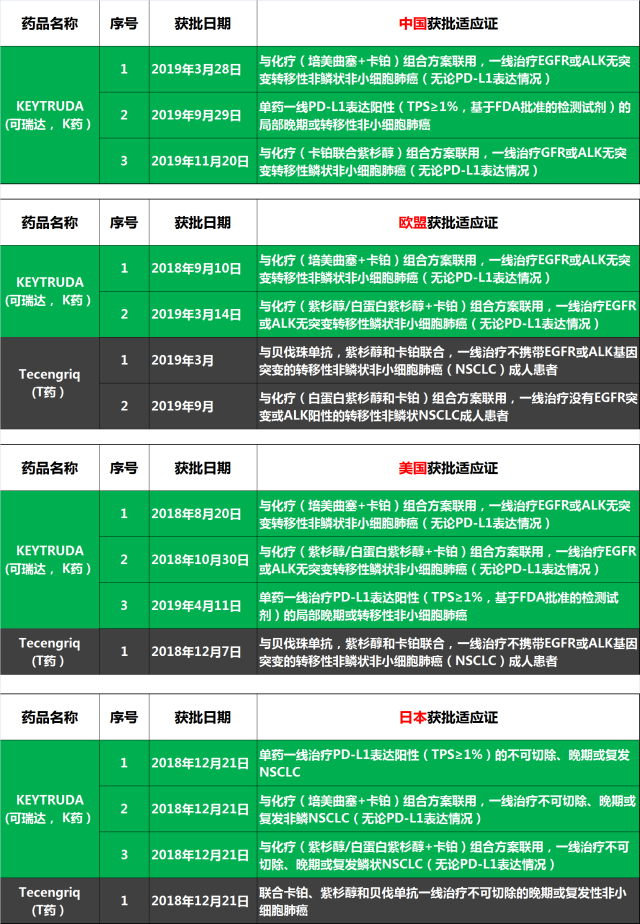
中国、美国和欧盟获批一线治疗 NSCLC 适应证的 PD-1/PD-L1 单抗一览图(K 药联合化疗一线治疗肺鳞癌仍在审批中)
循证医学「数据之王」
自 2019 年 3 月 28 日 K 药首次在国内获批一线治疗非鳞 NSCLC,在不到 8 个月内,K 药连续又斩获两个一线治疗适应证,源于其 III 期临床研究所展示的在 OS 数据上相比化疗方案的显著优势。
目前各国批准 K 药一线治疗肺鳞癌适应证都是基于一项大型的全球 III 期临床研究(KEYNOTE-407)的结果。该研究中期分析结果于 2018 年 ASCO 大会上首次公布并同步刊登在新英格兰医学杂志。在今年的 ESMO 大会上公布了 KEYNOTE-407 研究的最后结果。
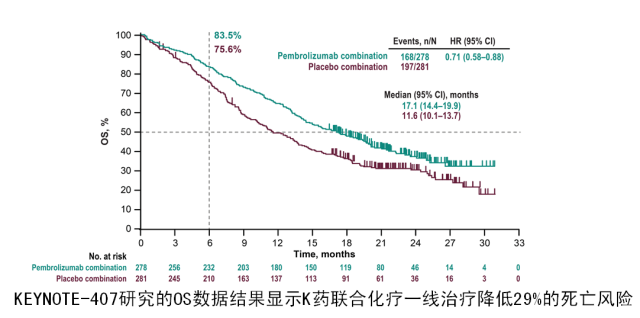
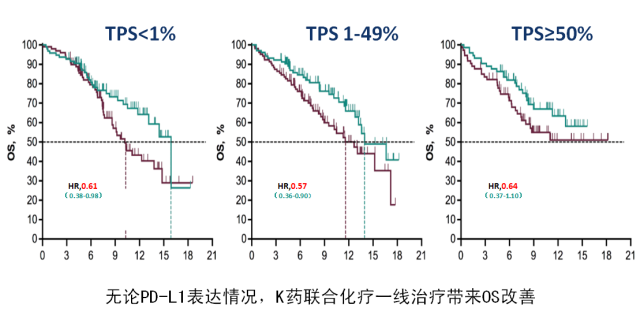
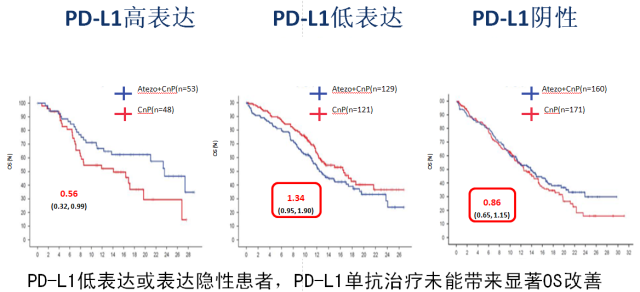
结果显示,在所有的意向治疗人群中,帕博利珠单抗联合化疗组的中位 OS 达到 17.1 个月(14.4~19.9 个月),而单纯化疗组仅有 11.6 个月(10.1~13.7 个月);帕博利珠单抗联合化疗降低 29% 的死亡风险(HR = 0.71, 95%CI:0.58~0.88)[2];而且无论 PD-L1 表达情况,K 药联合化疗一线治疗,相比单纯化疗方案能带来显著 OS 获益 [3]。
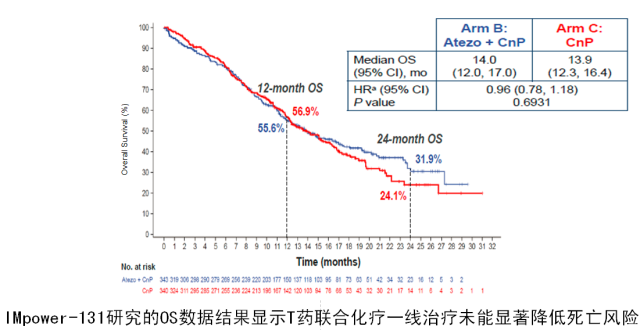
而另外一个在欧美和日本获批一线治疗非鳞 NSCLC 的 PD-L1 单抗 Tecentriq (T 药),在一线治疗鳞状 NSCLC 的 III 期临床研究(IMpower 131) 中则并未显示带来显著 OS 的改善,提示 PD-1 单抗和 PD-L1 单抗存在不同的临床疗效 [4]。
在免疫一线治疗非鳞 NSCLC 领域,当前已有多个 PD-1/PD-L1 单抗联合含铂和培美曲塞化疗方案的 III 期临床研究显示阳性结果,包括 K 药的 KEYNOTE-189,T 药的 IMpower-130 和 IMpower 132 研究,以及今年在世界肺癌大会上公布的国产 PD-1 卡瑞利珠单抗的 SHR1210-303 研究。
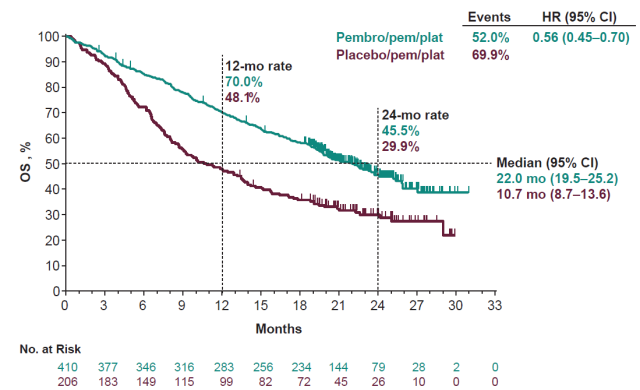
2018 年在美国 AACR 年会上公布了全球首个 PD-1 单抗联合化疗一线治疗非鳞 NSCLC 的全球 III 期临床研究(KEYNOTE-189)的分析结果。 结果显示,K 药联合化疗一线治疗方案相比化疗方案显著提高了 1 年总生存率(69.2% vs 49.4%, HR = 0.49; p<0.001),PFS(8.8 vs 4.9 个月,HR = 0.52; p<0.001),以及 ORR(47.6% vs 18.9%,p<0.001)[5]。在今年的美国临床肿瘤学年会上,KEYNOTE-189 的 18.7 个月的随访研究结果公布。 结果显示,帕博利珠治疗组的中位 OS 为 22.0 个月,化疗组 10.7 个月,死亡风险降低 44%[6]。
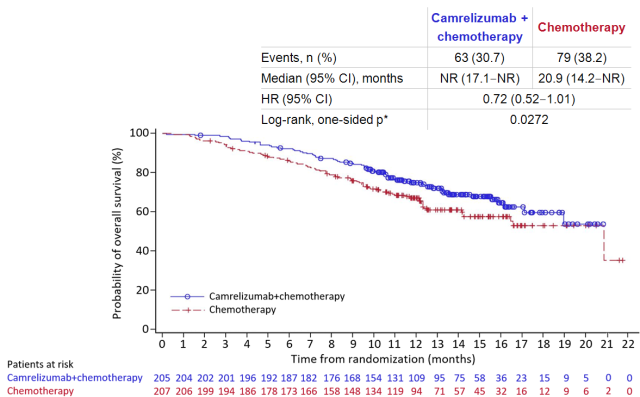
相比在 SHR1210-303 研究中卡瑞利珠单抗治疗组的中位 OS 未达到(17.1-NR), 化疗组达到 20.9 个月(14.2-NR), 死亡风险降低 28%[7]; K 药似乎具有更显著的疗效。
K 药的中国数据
KEYNOTE-189 研究没有纳入中国患者人群,而 K 药基于 KEYNOTE-189 在国内给予加速获批的联合化疗一线治疗非鳞 NSCLC 是国内第一个,也是目前唯一一个获批一线治疗 NSCLC 的适应证。 因此,K 药一线治疗中国 NSCLC 患者的疗效是否与欧美患者等同对于国内的临床医生一直是一个重要问题。
今年 9 月,在 2019 年世界肺癌大会(WCLC)上,由吴一龙教授牵头开展的 KEYNOTE-042 研究中国人群亚组和中国扩展研究结果显示,与中国晚期/转移性 NSCLC 患者的一线治疗相比,帕博利珠单抗单药治疗可改善患者 OS[8]。
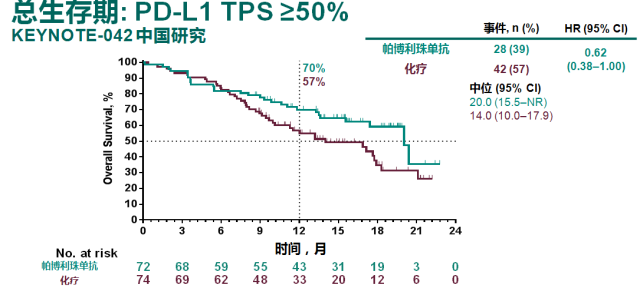
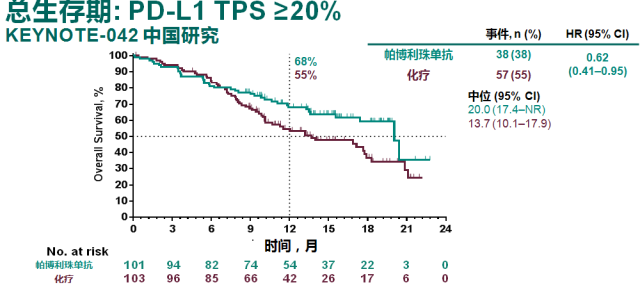
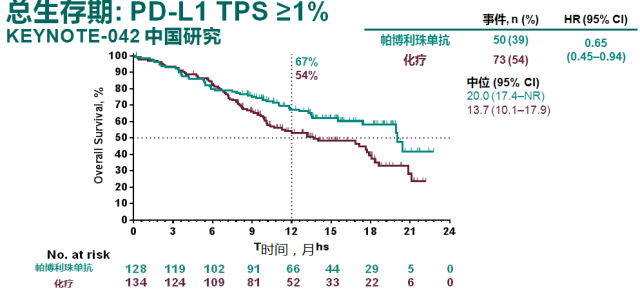
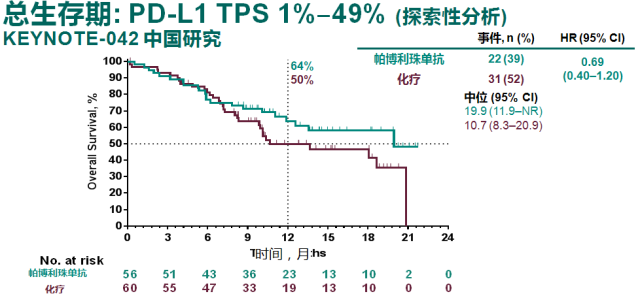
而且,对比中国人群和全球数据 [9],中国人群的 OS 数据从数值上优于全球数据,提示 K 药可能对于中国人群的疗效优于欧美人群。与整体人群数据所显示的随着 PD-L1 表达降低,OS 获益减弱的情况不同(19%-31%),K 药治疗中国患者带来的死亡风险降低幅度在不同 PD-L1 表达人群中稳定在 31%-38% 之间。
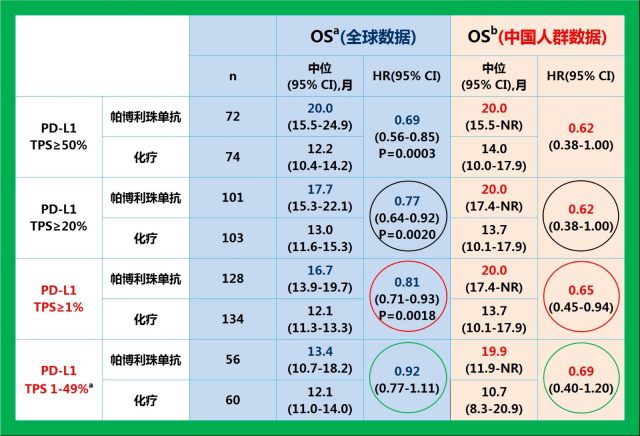
帕博利珠单抗单药一线治疗中国人群带来的 OS 获益和死亡风险的降低优于整体研究人群数据
今年 9 月 29 日,基于 KEYNOTE-042 研究的阳性结果,NMPA 批准 K 药单药一线治疗 PD-L1 表达阳性的局部晚期或转移性(TPS ≥ 1%)NSCLC(包括鳞和非鳞 NSCLC)的适应证。
KEYNOTE-407 研究及中国扩展研究入组了 125 例中国肺鳞癌患者,该研究结果将于明日在新加坡开幕的 ESMO ASIA 大会上公布。K 药是否展示类似的针对不同人种的疗效差异很值得期待。
K 药针对不同人种显示的疗效差异在 K 药治疗局部晚期和转移性食管癌的 KEYNOTE-181 研究中也有显示。值得注意的是,这一循证医学数据支持 K 药在治疗东西方人群时,可能存在疗效差异。
安全性数据最多的 PD-1 单抗
KEYNOTE-042,KEYNOTE-407,连同研究 K 药治疗不可切除转移性黑色素瘤的 KEYNOTE-151 研究,以及 K 药治疗局部晚期和转移性食管癌的研究 KEYNOTE-181 研究,累计入组了超过 500 例中国患者。K 药在这些研究中所展示的治疗相关性不良反应,以及 3-5 级不良反应与其在欧美国家获批适应证所基于的临床研究的结果一致,没有特别不同的不良反应发生。 而且 K 药单药治疗的不良反应以及 3-5 级不良反应仅为化疗组的四分之一至二分之一 [10] [11]。
以 PD-1/PD-L1 免疫检查点抑制剂为代表的肿瘤免疫治疗正在全球和中国彻底改变局部晚期和转移性 NSCLC 的临床实践。虽然免疫治疗的安全性可能要优于标准化疗,不良反应更小,但在临床实践中,必须关注免疫相关不良反应,尤其是某些 PD-1 单抗可能会因脱靶激活血管内皮生长因子受体 2(VEGFR2)的信号通路而导致独有的毛细血管增生引起的血管瘤的高比例发生。
K 药是目前在全球和中国获批一线治疗 NSCLC 适应证最多的 PD-1 免疫检查点抑制剂,也是获批一线治疗各类恶性肿瘤适应证最多(美国获批的 22 个适应证中, 9 个一线治疗适应证,覆盖 6 个不同瘤肿)、疗效和安全性循证医学证据最多,以及临床实践最多的用于一线治疗的 PD-1 免疫检查点抑制剂;这是 K 药被称为「免疫之王」的一个重要原因。
在欧美国家,免疫治疗已经改变了多个恶性肿瘤治疗的临床实践,在晚期 NSCLC 治疗领域,在 K 药的多个一线治疗临床研究的推动下,免疫治疗已替代化疗成为晚期 NSCLC 治疗的基础治疗。
在中国,随着 K 药联合化疗一线治疗鳞状 NSCLC 的获批,实现其对所有无驱动基因突变的晚期 NSCLC 患者的全覆盖,中国的免疫治疗有望迅速赶上欧美国家的临床实践,让中国所有无驱动基因突变的晚期 NSCLC 患者以最快的速度从免疫一线治疗中获得长期生存的「红利」。
[1] http://sq.nmpa.gov.cn/datasearch_nmpa/schedule/search.jsp?
[2] Paz-Ares, et al., Pembrolizumab Plus Chemotherapy in Metastatic Squamous NSCLC: Final Analysis and Progression After the Next Line of Therapy (PFS2) in KEYNOTE-407, 2019 ESMO, September 27-October 1s, 2019
[3] Paz-Ares L, et al. N Engl J Med. 2018;379(21):2040-2051
[4].Jotte RM, et al. Clin Oncol 2018; 36(18 Suppl): LBA9000.
[5] Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018; 378(22):2078-2092
[6] Gadgeel SM., et al. KEYNOTE-189: Updated OS and progression after the next line of therapy (PFS2) with pembrolizumab (pembro) plus chemo with pemetrexed and platinum vs placebo plus chemo for metastatic nonsquamous NSCLC." ASCO 2019 abstract 9013.
[7] Zhou CC, et al., A Randomized Phase 3 Study of Camrelizumab plus Chemotherapy as 1st Line Therapy for Advanced Non-Squamous Non-Small Cell Lung Cancer with negative EGFR and ALK, Abstract Presentation 2019 WCLC,
[8] Wu Y.L et al., KEYNOTE-042 China Study: First-line Pembrolizumab vs Chemotherapy in Chinese Patients with Advanced NSCLC with PD-L1 TPS ≥ 1%, Mini-Oral Presentation, 2019 WCLC
[9] Mok, T.S.K etal., Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomized, open label, controlled, phase 3 trial. Lancet, April 4th, 2019
[10] Wu Y.L et al., KEYNOTE-042 China Study: First-line Pembrolizumab vs Chemotherapy in Chinese Patients with Advanced NSCLC with PD-L1 TPS ≥ 1%, Mini-Oral Presentation, 2019 WCLC
[11] Chen J et al., Pembrolizumab Versus Chemotherapy in Patients with Advanced/Metastatic Adenocarcinoma or Squamous Cell Carcinoma of Esophagus as Second-line Therapy: Analysis of the Chinese Sub-group in KEYNOTE-181, Abstract Presentation, ESMO, September 27th, 2019
