2019 年 11 月 26 日,国家药品监督管理局(NMPA)药品评审中心(CDE)官网显示默沙东公司旗下帕博利珠单抗(俗称 K 药)的又一适应证完成审评审批。
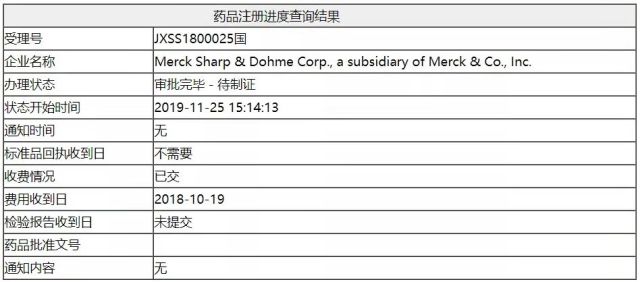
据查,该适应证于 2018 年 10 月 22 日,在 CDE 被正式受理(受理号:JXSS1800025)。此次获批的适应证为 PD-1 免疫检查点抑制剂帕博利珠单抗联合化疗(卡铂和紫杉醇)方案,一线治疗转移性鳞状非小细胞肺癌,无论 PD-L1 表达情况。
本次获批是基于一项大型的全球的 III 期临床研究(KEYNOTE-407)的结果。该研究结果于同年刊登在新英格兰医学杂志。
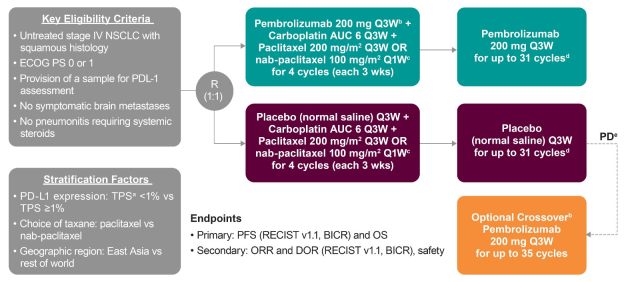
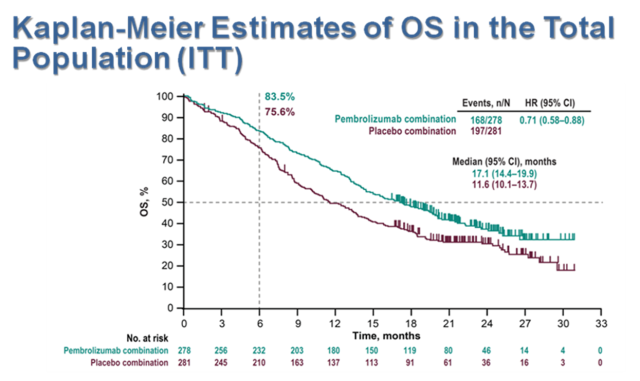
在今年的 ESMO 大会上公布了更新的 KEYNOTE-407 研究的 OS 数据和首次公布的 PFS2 结果更新结果显示。结果显示,在所有的意向治疗人群中,帕博利珠单抗联合化疗组的中位 OS 达到 17.1 个月(14.4~19.9 个月),而单纯化疗组仅有 11.6 个月(10.1~13.7 个月);帕博利珠单抗联合化疗降低 29% 的死亡风险(HR = 0.71, 95%CI:0.58~0.88);
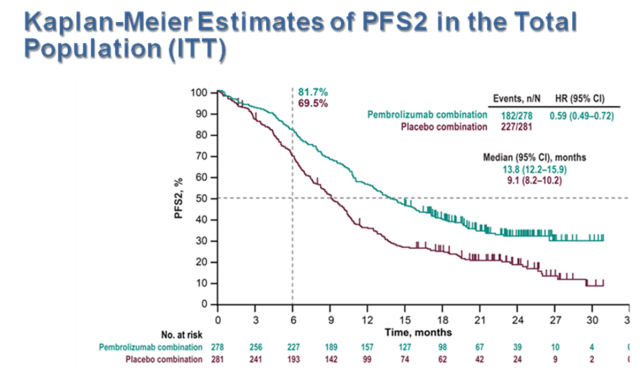
在单纯化疗组中有 49.1% 的患者接受后续的抗 PD-1/PD-L1 治疗的情况下, 帕博利珠单抗联合化疗组仍然为患者带来持续的 OS 获益。两组的中位 PFS2 分别为 13.8 个月和 9.1 个月(HR = 0.59;95%CI:0.49~0.72)。
据国家癌症中心今年发布的最新统计数据,我国 2015 年新增约 78.7 万肺癌患者,其中非小细胞肺癌(NSCLC)约占肺癌总数的 80%~85%, 其中已经发展为晚期或转移性肺癌患者约占 60%,鳞状 NSCLC 约占 30%。
目前中国晚期鳞状 NSCLC 的一线治疗主要还是以含铂化疗方案为主,缓解率 30% 左右,中位生存时间仅在一年左右,因此,中国晚期肺鳞癌的一线治疗仍面临极大困境,亟待解决。KEYNOTE-407 研究中国牵头人、吉林省肿瘤医院程颖教授指出,帕博利珠单抗联合化疗一线治疗鳞状 NSCLC 的客观缓解率达到 62.6%,而且显著延长总生存获益,有望彻底改变针对鳞状 NSCLC 的临床实践,让这批患者有机会得到长期长期生存获益。
帕博利珠单抗已分别在 2018 年 7 月,2019 年 3 月以及 2019 年 9 月在国内获批单药治疗不可切除的转移性黑色素瘤、联合化疗一线治疗非鳞 NSCLC,以及单药一线治疗 PD-L1 表达阳性(TPS ≥ 1%)NSCLC(包括鳞和非鳞 NSCLC)的适应证,此次适应证的获批是帕博利珠单抗在华获批的第四个适应证,也是其获批的第三个一线治疗 NSCLC 的适应证,使其成为在国内,以及在晚期肺癌治疗领域,获批适应证最多的 PD-1 单抗。
此次获批适应证标志着帕博利珠单抗在国内已完成一线治疗无驱动基因突变的 NSCLC 的最后一块「拼图」, 堪称在这一治疗领域的「免疫之王」。同时,此适应证的获批也必将进一步推动树立免疫治疗作为晚期 NSCLC 一线治疗的基石地位,从而彻底改变国内晚期 NSCLC 一线治疗的临床实践,让中国所有的无驱动基因突变的晚期 NSCLC 患者都有机会获得免疫治疗可能带来的长期生存的「红利」,并助力提升我国晚期肺癌的五年生存率。
