
约15%的肺癌手术患者可发现2处以上肺部恶性病变,鉴别这些病灶是多原发肺癌还是肺内转移对于后续治疗的选择至关重要。公认的鉴别标准多依赖于临床和组织学因素。在精准医学时代,随着病理和分子检测技术的发展,多发肺病变也需要被重新审视。
一 临床及组织学分类
1975年,Martini和Melamed提出多原发肺癌的诊断标准(M&M标准,表1)[1],基于肿瘤部位和主要病理类型进行鉴别。M&M标准是经验性的临床工具,界定较粗糙,也未经过真正的验证。不过它确实为后来的标准提供了基础。

表1 多原发肺癌诊断标准(Martini & Melamed 1975)
2007年,美国胸科协会(ACCP)也发表了多发肺癌的鉴别指南(表2)[2]。指南包含了一些M&M标准的特点,有更细致的组织学评估内容。但是它没有考虑其他临床特点,也有一些未能定义的灰色地带(如间隔2-4年的异时性肿瘤)。
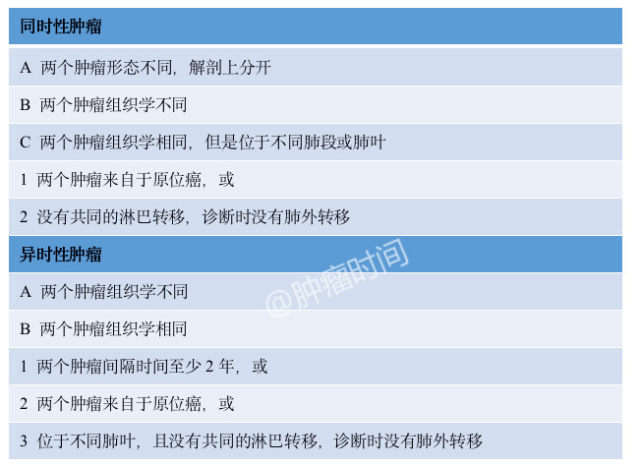
表2 多发肺癌诊断标准(ACCP)
此后发现多原发肺癌可以有淋巴结受累,复发时间超过2年也可能是肺内转移,且这两种分类方法无助于把相同生物学状况的肿瘤聚类,因此不能完全满足临床需要。
二 分子分类
多发肺癌的分子改变引起了人们的强烈兴趣,因为它们是致癌过程中的早期事件,在同一克隆来源的原发灶和转移灶中应该相同[3]。越来越多的证据支持肿瘤分子分析可能有助于多发肺癌的鉴别,这些技术正在逐步融入主流临床应用[4]。
1 特定突变
对肿瘤进行多断面检测以及原发灶和转移灶、原发灶和复发灶EGFR突变比较,发现77对原发和转移灶以及54对原发和复发灶突变形式一致,因此单区域测序已经足够发现局部肺腺癌的大部分已知癌症基因突变,EGFR突变的异质性分布十分罕见[5]。
但是突变的检测会被这些基因的常见程度以及检测技术敏感性、标本质量等影响。在肺腺癌中使用4个驱动癌基因(KRAS,EGFR,BRAF和ALK),发现形态和分子分类仅有70%的一致性[4],因此不能证明突变和克隆的绝对相关性,突变数据应和其他数据(临床,影像,形态)一起考虑。
2 比较基因组杂交(comparative genomic hybridization, CGH)和二代测序(next generation sequencing, NGS)
详细的基因评估,如使用CGH和NGS等方法检测杂合子丢失、各种基因特征和基因重排等增加了分子检测的准确性,对多发肺癌具有更好的鉴别力,但它们价格昂贵,对实验要求高,证据仅限于一些小型研究,还未在临床上广泛使用[6]。
三 综合组织学分类(comprehensive histologic subtyping, CHS)
CHS不仅需要明确组织学亚型比例,而且需要记录细胞和基质特征等额外组织学细节(图1)。由于肺癌转移后病理特征得以保留,且肺癌病理形态和分子特征具有一定的相关性,因此CHS成为鉴别多原发和肺内转移的有力工具[7]。
CHS和详细分子评估具有91%一致性[8],而且可以比分子或M&M标准更好地预测生存[7]。然而,CHS只能在术后标本中进行,因此虽然是一线工具,但应用受限。
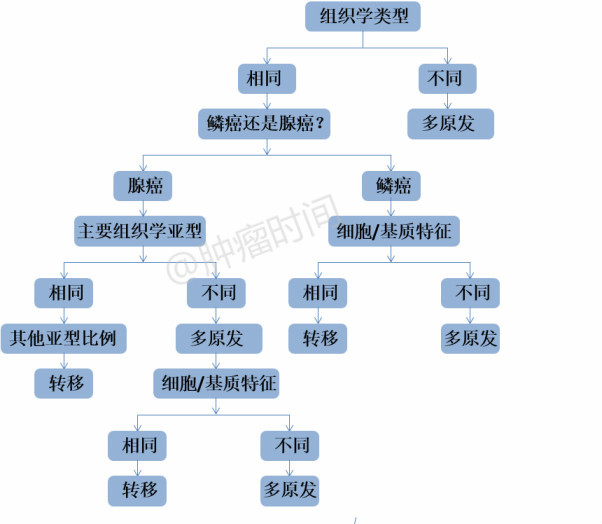
图1 CHS鉴别多发肺癌流程
四 联合组织学分子算法
2019年,有学者提出联合使用WHO 2015组织学分类和包括22个热点基因的NGS的分子特征综合对肿瘤进行分类(图2)[9]。这种方法比单纯组织学分类或分子检测有更好的鉴别效力,但还需要大型前瞻性研究来验证其价值。
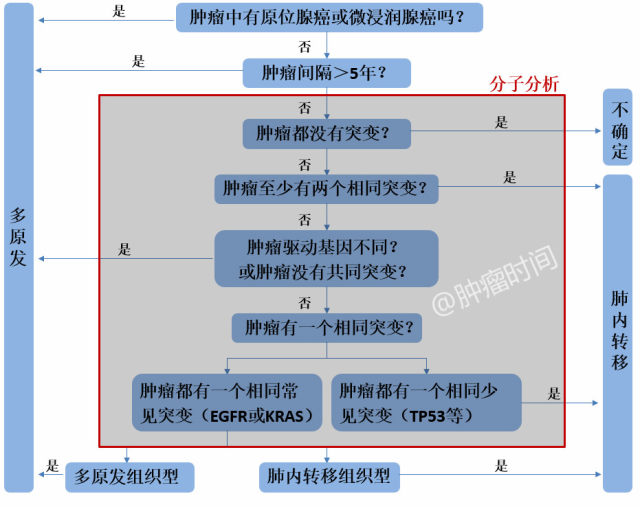
图2 鉴别多发肺癌的组织学分子算法
综上,对于手术切除的标本来说,CHS是更为可信的鉴别工具。而在无法手术和病理条件不足的患者中,综合使用组织学和突变特征可能是一种良好的鉴别多原发肺癌和肺内转移的方法,特别是在CGH和NGS等技术的辅助下。
参考文献
1 Martini N et al. Multiple primary lung cancers. J Thorac Cardiovasc Surg. 1975 Oct;70(4):606-12.
2 Shen KR et al. Special treatment issues in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest. 2007 Sep;132(3 Suppl):290S-305S.
3 Vignot S et al. Next-generation sequencing reveals high concordance of recurrent somatic alterations between primary tumor and metastases from patients with non-small-cell lung cancer. J Clin Oncol. 2013 Jun 10;31(17):2167-72.
4 Asmar R et al. Use of Oncogenic Driver Mutations in Staging of Multiple Primary Lung Carcinomas: A Single-Center Experience. J Thorac Oncol. 2017 Oct;12(10):1524-1535.
5 Yatabe Y et al. Heterogeneous distribution of EGFR mutations is extremely rare in lung adenocarcinoma. J Clin Oncol. 2011 Aug 1;29(22):2972-7.
6 Detterbeck FC et al. The IASLC Lung Cancer Staging Project: Background Data and Proposed Criteria to Distinguish Separate Primary Lung Cancers from Metastatic Foci in Patients with Two Lung Tumors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016 May;11(5):651-665.
7 Girard N et al. Comprehensive histologic assessment helps to differentiate multiple lung primary nonsmall cell carcinomas from metastases. Am J Surg Pathol. 2009 Dec;33(12):1752-64.
8 Arai J et al. Clinical and molecular analysis of synchronous double lung cancers. Lung Cancer. 2012 Aug;77(2):281-7.
9 Mansuet-Lupo A et al. Proposal for a Combined Histomolecular Algorithm to Distinguish Multiple Primary Adenocarcinomas from Intrapulmonary Metastasis in Patients with Multiple Lung Tumors. J Thorac Oncol. 2019 May;14(5):844-856.
