作者:「肺」越一线
美国时间 4 月 11 日下午 17:45, 默沙东(MSD)公司宣布,美国 FDA 批准其 PD-1 免疫检查点抑制剂帕博利珠单抗(国内俗称「K 药」)作为单药一线方案治疗无 EGFR 或 ALK 基因突变的,PD-L1 表达阳性(TPS ≥ 1%)的 III 期不可手术,或不适合放化疗治疗, 或转移性非小细胞肺癌(NSCLC)患者。
「K 药」完成肺癌治疗「全垒打」
2016 年 10 月帕博利珠单抗在美国获批单药一线治疗 PD-L1 高表达(TPS ≥ 50%)NSCLC(无论鳞状还是非鳞状细胞癌),成为首个获批治疗晚期肺癌的一线 PD-1 单抗。 此次扩展适应证的获批是至今在美国获批的仅仅第二个 PD-1/PD-L1 单抗单药一线治疗 NSCLC 的适应证(在美国已有六个 PD-1/PD-L1 单抗获批应用于临床治疗)。
除了单药一线治疗 NSCLC 的两个获批适应证外,帕博利珠单抗还分别在 2017 年 5 月和 2018 年 10 月在美国相继获批联合标准化疗一线治疗非鳞和鳞状 NSCLC,无论 PD-L1 表达状态(TPS<1%, 1%≤ TPS<50%, 或 TPS ≥ 50%)。

至此,凭借这四个一线适应证的正式获批,帕博利珠单抗实现了针对无 EGFR 或 ALK 驱动基因突变的 NSCLC 一线治疗的「全垒打」, 全面覆盖这类 NSCLC 患者,无论是鳞还是非鳞 NSCLC, 无论 PD-L1 表达情况,无论是单药还是联合治疗。

帕博利珠单抗是目前全球获批一线治疗晚期肺癌适应证最多的 PD-1 单抗,而 KEYNOTE 研究系列结果也为推进肿瘤免疫治疗的发展, 为推动肺癌治疗进入「Chemo-free 」时代立下了「汗马功劳」;同时,这些系列研究结果也让帕博利珠单抗成为了 PD-1/PD-L1 单抗治疗晚期肺癌领域的「王者」。
「K 」药的总生存(OS)数据最全面
帕博利珠单抗在美国正式获批的四个一线治疗 NSCLC 适应证所基于的循证医学数据都显示其能为患者带来比单纯的标准化疗更优越的总生存(OS)获益。总生存获益是衡量抗肿瘤药物疗效的唯一「金标准」。
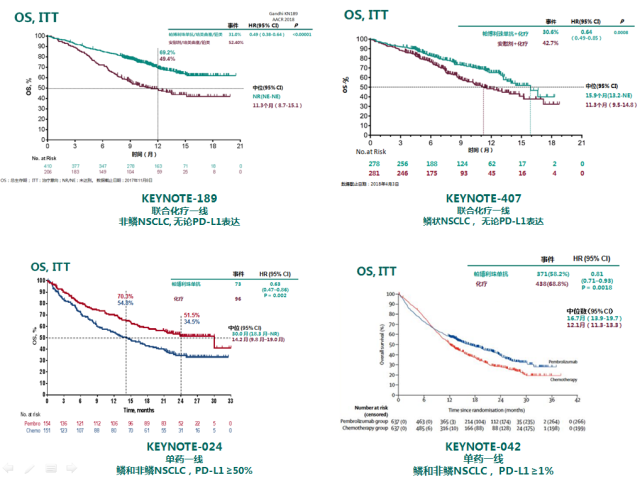
此次扩展适应证获批所基于的 3 期临床研究 KEYNOTE-042 的研究结果刚于获批一周前(4 月 4 日)在知名医学期刊《柳叶刀》(Lancet)杂志的主刊在线发表。
PD-L1 分层研究结果显示, 帕博利珠单抗单药一线治疗在针对不同 PD-L1 表达的患者治疗中,都显示相比当前的标准化疗方案能带来更优越的总生存获益。
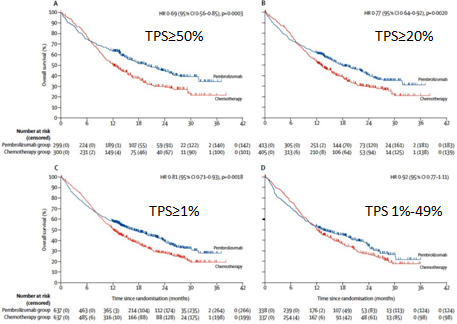

KEYNOTE-042 研究结果再次印证了 KEYNOTE-024 的研究结果,显示帕博利珠单抗单药一线治疗 PD-L1 高表达 NSCLC 所带来的 OS 获益,进一步确立了帕博利珠单抗治疗这批患者的一线标准治疗的地位。同时,研究结果也显示单药一线治疗为更广泛人群带来的 OS 的获益也优于化疗方案,从而进一步扩大了"chemo-free" 治疗方案可适用的 NSCLC 患者。 同时,此次帕博利珠单抗扩展适应证的获批也给了临床医生更多的治疗选择, 尤其是当治疗那些不耐受、不适合或不愿意接受化疗方案的患者时。
KEYNOTE-042 研究的主要研究者之一,广东省人民医院终身主任, 广东省肺癌研究所名誉所长吴一龙教授点评道:
「PD-L1 阳性表达 TPS 评分 ≥ 50%,帕博利珠单抗单药大大优于化疗;阳性表达在 1%~49% 的患者,帕博利珠单抗可以和化疗平起平坐,这就是改变临床实践的研究。」
「K 药」在国内将「高歌猛进」
肺癌是国内发病率和致死率最高的恶性肿瘤。 根据国家癌症中心最新发布的数据统计,中国在 2015 年有超过 78 万人确诊为肺癌,其中超过 62 万人因此而去世。NSCLC 是最常见的肺癌类型, 占肺癌总数的 85%。
在过去十多年里,多个肿瘤靶向治疗药物在国内上市,基于这些药物的一线治疗方案针对 EGFR/ALK 等驱动基因突变的晚期 NSCLC 患者显示了很好的疗效,以及显著的无疾病进展生存(PFS)获益,但是对于无驱动基因突变的肺癌患者的疗效却基本无效;对于这些患者, 化疗是最常用的一线治疗方案,但疗效不佳,中位 OS 不超过一年。
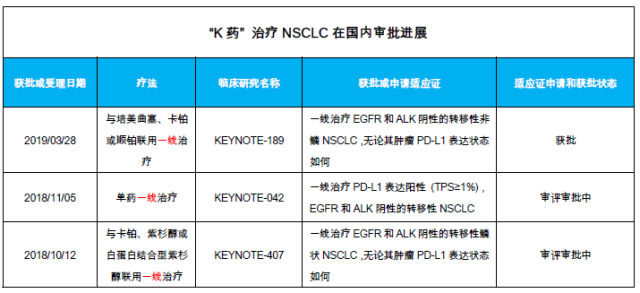
在国内,国家药品监督管理局已于今年 3 月 28 日批准帕博利珠单抗联合培美曲塞和铂类化疗药物一线治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞非小细胞肺癌, 让 PD-1 单抗在国内首次进入了一线治疗晚期肺癌以及肿瘤的行列,有望显著提升国内无驱动基因突变 NSCLC 患者的总生存获益。
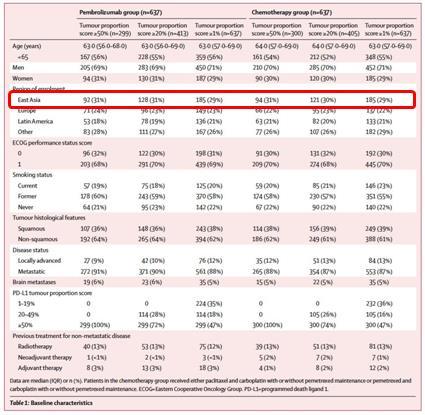
《柳叶刀》在线发表的 KEYNOTE-042 研究结果显示, 数据统计纳入了 370 例东亚人群(主要是中国肺癌患者)的数据,国内患者的数据尚未公布,其结果是否更好值得期待。
根据国家食品药品监督管理总局官网显示,其药品评审中心已于 2018 年 11 月 9 日正式受理帕博利珠单抗单药一线治疗 PD-L1 表达阳性(TPS ≥ 1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的上市申请;预计今年基于 KEYNOTE-042 研究结果的「K 药」单药一线治疗 NSCLC 适应证也有望获批。
另外,2018 年 10 月 20 日,国家食品药品监督管理总局药品评审中心也正式受理了帕博利珠单抗联合标准化疗(卡铂和紫杉醇或卡铂和白蛋白紫杉醇)一线治疗鳞状非小细胞肺癌的上市申请。如果基于 KEYNOTE-407 研究结果的适应证也于今年获批,那在国内,PD-1 单抗也将像在美国一样,全面「进驻」晚期肺癌的一线治疗,并成为无驱动基因突变的晚期 NSCLC 的一线标准治疗方案。