miRNA 与癌症的关系
microRNA(miRNA)是一类由内源基因编码的, 长度约为 22 个核苷酸的非编码单链 RNA 分子,它们是基因表达的转录后调控因子。单个 miRNA 已被证明可以调节多个基因的表达,同时,单个基因的表达也可以被多个 miRNA 调控。因此,自 20 多年前被发现以来,miRNA 已被确认为是与正常生理和疾病(例如癌症、肌肉疾病和神经变性)发病机制相关的,复杂生物过程中的关键调控因子。
miRNA 与癌症特征之间联系的示意图如下图。人类癌症具有许多特征, 包括持续增殖信号、逃税的生长抑制、激活入侵和转移、复制的永生、血管生成、抵抗细胞死亡、逃避免疫破坏等等。每个特征都展示了三个影响特定类型癌症中特定细胞功能的 miRNA 的例子。值得注意的是,一些 miRNA 会影响一个以上的信号,指示其调控的多种途径。
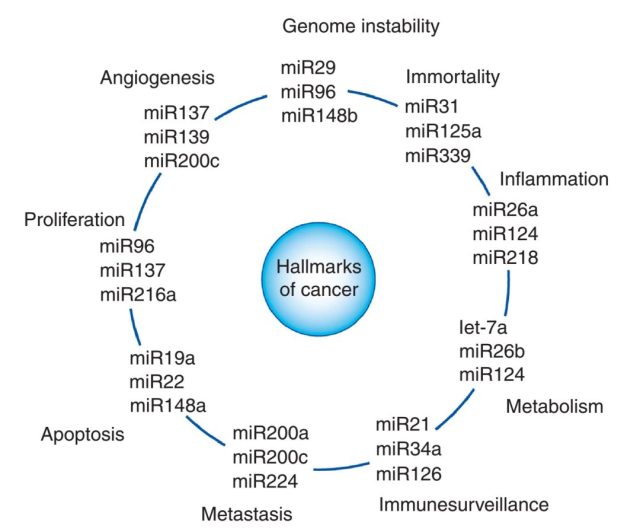
Frank J. Slack 教授首次在人体中发现 miRNA(目前是普未的科学顾问),曾发文表示,自第一个 miRNA 被发现以来的 20 多年里,miRNA 生物学领域已经有了长足的发展。通过深入了解 miRNA 在癌症发生发展中的作用,miRNA 能成为新的癌症治疗方法中的工具和靶点。功能研究证实,在许多癌症病例中,miRNA 失调是病因。作为肿瘤抑制因子或癌基因,miRNA 的模拟和分子靶向 miRNA,即抗-miRNA 的分子,在临床前发展中显示出希望。一些 miRNA 靶向治疗已进入临床开发阶段,包括对肿瘤抑制因子 miRNA- 34 的模拟(该模型已进入治疗癌症的临床试验阶段),以及针对 miR-122 的抗-miRNA(该模型已进入治疗肝炎的 II 期试验阶段)。
miRNA 作为肿瘤标志物潜力
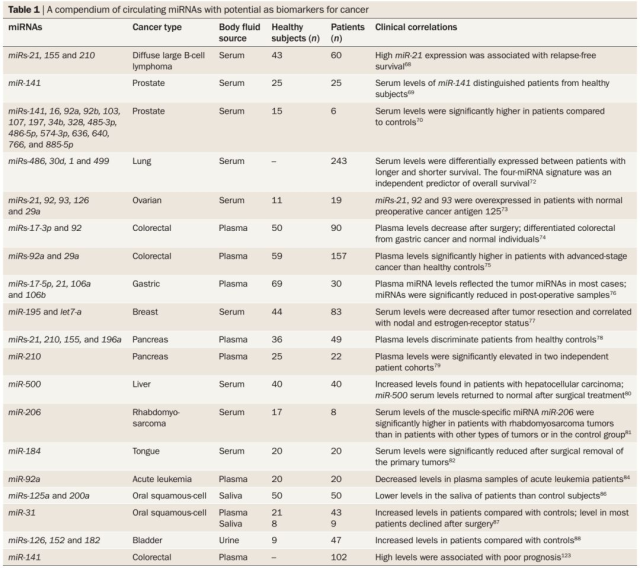
多数的癌症都缺乏早期或筛查的肿瘤标志物。miRNA 有成为肿瘤标物的潜力,原因就在于它们有一些理想肿瘤标志物的特征,例如:miRNA 在癌细胞和组织有特异性表达谱,而且可以进入体液循环。与其他 RNA 相比,在新鲜或福尔马林固定组织和体液中相对较高的化学稳定性,是 miRNA 的另一个优势,它增加了 miRNA 作为诊断标记的潜力。
由于 miRNA 是由健康细胞和癌细胞释放出来的,许多人试图确定特定表达特征的含义,如潜在的血液、尿液或粪便为基础的诊断标志物。尤其是在其他早期检测方法不可用、昂贵甚至对患者有害的癌症中,基于 miRNA 的生物标志物检测可能具有在常规临床实践中建立的机会。
血清,血浆和其他体液中,都可以检测到循环游离的 miRNA。成熟的 miRNA 在体液中非常稳定,并且在不同癌症状态下具有极高的特异性,这使得 miRNA 可以作为人类癌症的潜在非侵入性肿瘤标志物。
下图展示了不同的 miRNA 作为癌症的肿瘤标志物的潜力。
miRNA 的检测
miRNA 能否成为肿瘤标志物,也受检测方式的因素影响。目前,检测 miRNA 的方法分为直接检测和间接检测两个类别。直接检测方法主要包括荧光,比色和基于电学的方法等,这些方法可以使样品测量期间引入的变化达到最小化,但是受到灵敏度低和 miRNA 同源物之间差异的限制。间接检测方法主要包括 Northern 印迹,微阵列和实时反转录聚合酶链反应(RT-qPCR)。虽然广泛使用,但 Northern 印迹和微阵列方法都是半定量的,并且敏感性差,同时需要大量的起始 RNA。相比之下,RT-qPCR 是定量检测 RNA 的最灵敏和最有效的方法。
RT-qPCR 在临床实验室中很容易进行,它产生的数据比基因表达阵列和深度测序的更容易分析; 也更具有可重复性。这种技术提供了高吞吐量,因为样品可用 384 孔板进行分析,因此成本相对较低。同时在技术上具有挑战性的原位杂交可能在细胞水平上提供更多的 miRNA 表达信息。
与此同时,RT-qPCR 的检测方法可以实现从从「实验台」到「床边」的过渡。它是一种成熟的、稳健的、可重复的技术,具有许多关键的优势,包括其高灵敏度和特异性、靶向多路复用的潜力,以及低 RNA 输入需求——即使是在材料有限的临床标本中,所有这些都有助于表达分析。由于 RT-qPCR 的实验室开发测试 (LDT) 的验证远没有基于其他平台 (如微阵列或下一代测序) 的测试复杂,它符合临床实验室改善计划(CLIA)规定的准确性、精确性、敏感性和特异性的要求。
普未 miRNA 检测技术,简便、可靠的基于 RT-qPCR 的 miRNA 检测
基于 TaqMan 探针的实时 RT-qPCR 已被广泛应用于 miRNA 的高效和特异性检测。但随着通过深度测序逐步鉴定数百种候选 miRNA,TaqMan 探针针对每种新型 miRNA 的设计不仅成本过高,而且技术上具有挑战性。
普未提出了将脱氧尿嘧啶结合的 RT 寡核苷酸与二级结构和半嵌套实时 PCR 结合的新方法,用于直接从培养细胞中快速而稳健地定量成熟 miRNA。该 miRNA 测定显示出高动态范围,高效率和检测灵敏度以及靶向成熟 miRNA 与其前体形式和同源家族成员的良好区分。
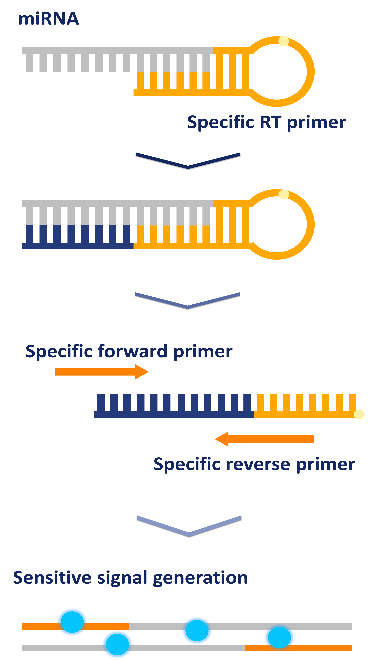
普未设计了一种通过半嵌套实时 RT-PCR 特异性检测成熟 miRNA 的简便方法,如下示意图所示,通过设计半嵌套反向 PCR 引物而不是使用普通或通用反向 PCR 引物,可以实现检测 miRNA 特异性的增加。
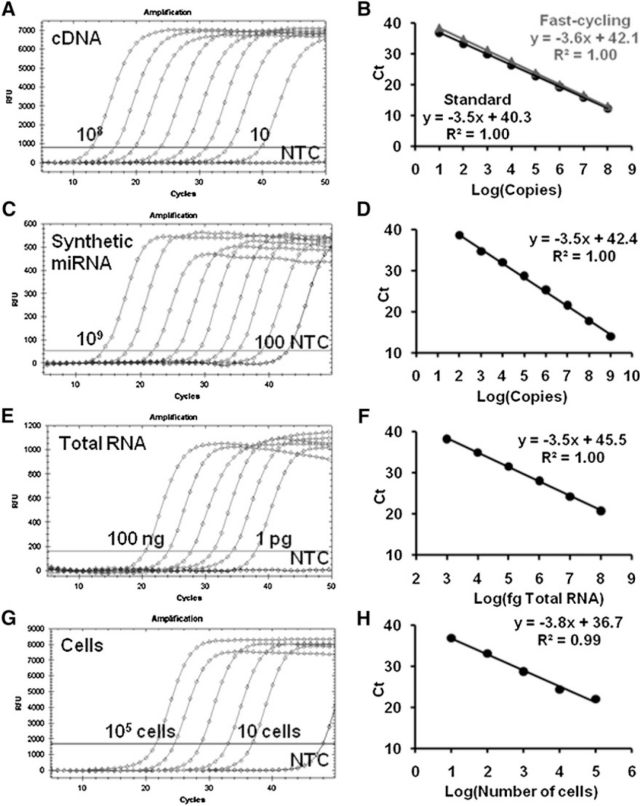
普未对半嵌套实时 RT-PCR 性能进行了测定,如下示意图,分别显示了 cDNA 稀释液在快速和标准两种循环谱下、合成的 miRNA 稀释超过 7 个数量级后进行定量、从 100ng 至 1pg 的总 RNA 进行定量、从 100,000 至 10 个细胞分离的总 RNA 进行定量等均表现出优异的动态范围和线性,这证明了该测定在快速检测、总 RNA 是微量(1pg)下、少至 10 个细胞的 miRNA 检测等不同情况下的高度可靠性。
普未 miRNA 检测对于循环 miRNA 肿瘤标志物的测定优势明显
循环 miRNA 作为肿瘤诊断或预后的标志物潜力巨大,但是体液中循环 miRNA 的检测和分析在技术上和生物学上都是具有挑战性的。miRNA 非常短,并且许多仅相差 1-2 个核苷酸。相比于细胞或组织中的 miRNA,大多数循环 miRNA 都在低丰度表达,并且在健康和疾病状态之间,显示的表达差异极小。
TaqMan 探针的实时 RT-qPCR 已被广泛应用于 miRNA 高通量分析平台,但测序和微阵列缺乏检测循环 miRNA 所必需的灵敏度和特异性,定量 PCR 是 miRNA 检测和定量的黄金标准,但由于劳动力和成本,其用于肿瘤标志物的研究相对有限。
普未的 miRNA 检测技术,不仅简便、可靠,适合极少量的 miRNA 检测。同时在对人体液中高度同源,和中、低表达量的 miRNA 检测方面,优于其他检测方式,这使得它用于循环 miRNA 肿瘤标志物的发现和测定前景广阔。
下图显示了从 200μl 血清中检测 590 种循环 miRNA,普未相较于其他技术方式,在中、低表达量上的显著优势。
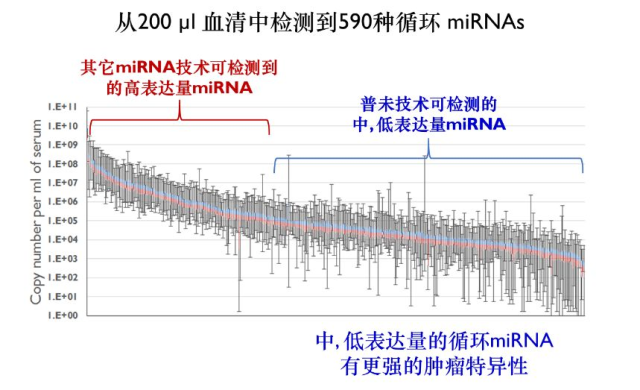
普未 12-miRNA 检测用于胃癌的筛查
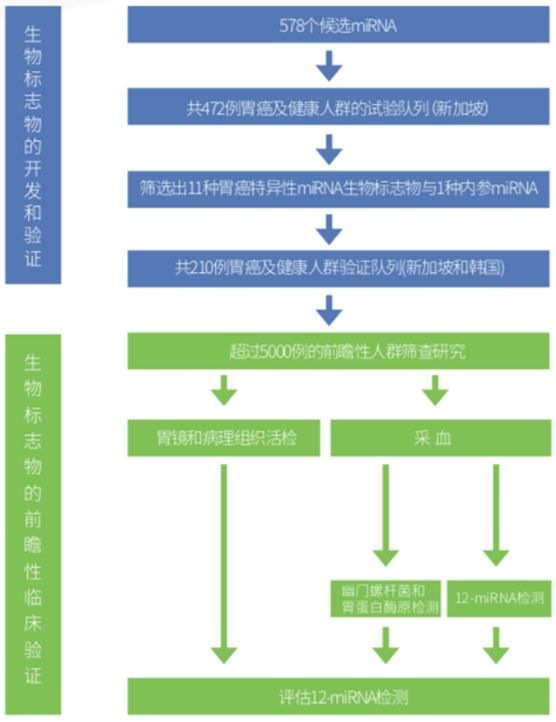
普未基于自己专利的 miRNA 检测技术,通过对近 6000 例胃癌和健康人群的研究,完成了胃癌 12-miRNA 的开发和两个阶段的验证,准确度达 87%,优于其他相关的胃癌相关肿瘤标志物。普未希望通过开展人群的胃癌的早筛,帮助临床提高胃癌的早期诊断率,从而将中国胃癌五年生存率提高到国际领先水平。
普未是致力于中国人群癌症早筛临床应用产品的医学技术转化平台,后续还将开发和推广更多种癌症的筛查产品,希望通过癌症早筛,实现癌症早发现、早治疗,提高癌症患者生存率和生存质量,减少家庭负担,节约社会医疗资源。
引文:
Wan G, Lim Q and Too HP, High-performance quantification of mature microRNAs by real-time RT-PCR using deoxyuridine-incorporated oligonucleotides and hemi-nested primers[J]. Rna-A Publication of The Rna Society, 2010, 16: 1436-1445
图片来源:普未
