ESMO 日前发布了肝细胞性 肝癌(HCC)临床实践指南,就概况、诊断、分期、治疗等方面进行了详细规范。
发病率
在过去的 20 年中,HCC 的发病率逐年攀升,在男性及女性高发肿瘤中分别排第 5 及第 9 位。HCC 的发病率从西方国家的 3/100000 到蒙古的 78.1/100000 不等,在非洲和亚洲发病率最高。
诊断
HCC 的诊断基于病理检查和/或造影增强的影像学结果。表 1 列出了疑诊 HCC 患者所需进行的检查。
表 1. 诊断检查
| 病史及临床检查 | 慢性肝脏疾病的危险因素(如:药物滥用、酒精摄入、代谢综合征) 慢性肝脏疾病的症状及体征(如:黄疸,腹水,脑病,出血,脾肿大) PS 评分(区分近期发病的癌症相关症状与肝硬化相关的长期症状)及营养状态 |
| 实验室检查 | 肝病的病因:HBV(至少查 HBsAg 和抗 HBc),HCV(至查少抗-HCV),铁状态,自身免疫疾病 肝功能:凝血酶原、白蛋白、胆红素 肿瘤标志物:血清 AFP |
| 门脉高压的评估 | 上消化道内镜检查:静脉曲张和/或高血压性胃病 可选:经颈静脉压测量肝静脉压力梯度 |
| 影像学结果 | 肝脏动态(多期)MRI 或 CT 研究,用于诊断和评估肝脏内肿瘤范围(结节的数量和大小,血管侵犯,肝外扩散) 如果不能进行 CT 扫描或 MRI 检查,对比增强超声也可用于 HCC 的无创诊断,但不适用于胸部、腹部和骨盆的肿瘤分期以排除肝外扩散 |
| 组织活检 | 对影像学未明确诊断的结节有意义 需要诊断非肝硬化性 HCC 所有临床试验应该按照国家或机构政策进行,并支持以中心为基础的创新治疗方法 理想情况下,在用于科学目的时,应评估肿瘤和非肿瘤组织 |
(1)影像学诊断
在>1 cm 直径的结节中识别出 HCC 的典型血管特征 (动脉期血管高强化,门静脉或延迟期密度迅速下降) 则可确诊。与多层螺旋 CT (MDCT) 相比,多相 MRI 对基于典型血管特征的 HCC 的诊断灵敏度有适度的提高。
基于扩散加权成像和肝胆造影剂的使用等技术,MRI 可将结节识别为高风险结节并将结节分层(HCC 不显示典型的影像学特征或高级异常增生结节)。
新的 HCC 诊断成像标准称为 CT / MRI LI-RADSVR v2018(肝脏影像报告和数据管理系统)包括动脉期增强、肿瘤大小、对比剂洗脱、包膜和阈值增长。(表 2)
表 2. CT / MRI LI-RADS 诊断表
| 未经治疗的病灶:HCC 高风险但未经病理证实者 | 肯定良性:LR-1 可能良性:LR-2 由于图像质量下降或遗漏,无法分类:LR-NC 静脉内癌栓(TIV):LR-TIV 可能或肯定恶性,但不具 HCC 特征:LR-M |
| 否则,请使用下面的 CT / MRI 诊断表 | 中等概率为恶性肿瘤:LR-3 可能 HCC:LR-4 肯定 HCC:LR-5 |
| 动脉期超强化(APHE) | 非 APHE APHE(非边缘) |
计数主要特点 直径 <20 ≥20 <10 10-19 ≥20 ·对比剂洗脱 ▕ 无 LR-3 LR-3 LR-3 LR-3 LR-4 ·包膜 ▕ 1 LR-3 LR-4 LR-4 LR-4/LR-5 LR5 ·病灶增大超过界值 ▕ ≥2 LR-4 LR-4 LR-4 LR-5 LR5 |
对于对比增强超声(CEUS),HCC 和胆管细胞癌(CC)在 CEUS 下的血管轮廓具有一定重叠。但最近的数据表明,CEUS 是诊断肝硬化肝癌的一种合适的非侵袭性技术。CEUS 下 HCC 的典型特征与 CT/MRI 略有不同,在 CEUS 中,HCC 特征是动脉高度增强,随后出现轻度 (> 60 s) 消退。
血管造影和氟脱氧葡萄糖 - 正电子发射断层扫描(FDG-PET)扫描不推荐用于 HCC 诊断。当肿瘤活检未能证实局灶性病变的相关性时,可以根据肿瘤大小考虑第二次肿瘤活检、使用不同的对比增强成像模式或(如果可接受的)直接切除病变。
(2)病理诊断
HCC 的病理诊断基于肿瘤的活组织检查或手术标本。同时对肿瘤灶以外的肝脏组织进行分析可能有助于确定其状态及潜在的致病因素。切除病灶后遵循 TNM(肿瘤,淋巴结,转移)分类进行评估,包括切除边缘评估。
肿瘤活检的组织病理学诊断依赖于标准的 (H&E) 和特殊的染色 (如网状素),如果需要,则采用免疫组化(IHC)。
由于治疗方式不同,将 HCC / CC 与 HCC 区分开来十分重要;然而,在活组织检查中可能看不到混合的分化特征。此外,已证实 HCC 显著表达 CK19,并且是 HCC 预后不良的标志。
在高度分化的 HCC 中,从活检中通常看不到恶性肿瘤的明确迹象 (间质或血管侵犯)。需进一步的统一的组织学 (小梁改变——超过两个细胞宽小梁、假腺体、网状细胞丢失、包膜形成) 和细胞学标准 (核/质比增加,即「核拥挤」、细胞质嗜碱性细胞增多) 支持 HCC 诊断。
IHC 应在不明确的病例中进行:可以使用 CD34 免疫组化评估血窦的毛细血管化。进一步的免疫组化标记已被证明可以改善高分化 HCC 的诊断,包括谷氨酰胺合成酶,磷脂酰肌醇蛋白聚糖 3,CTC,EZH2 和 HSP70。
可用谷氨酰胺合成酶、磷脂酰肌醇蛋白聚糖 3 和 HSP70 三种标志物结合起来诊断(2/3 标志物阳性对 HCC 具有 70% 的敏感性和 100% 特异性),进一步使用其他标志物似乎可增加灵敏度。
分期和风险评估
HCC 的分期对于确定最佳治疗的结果和计划非常重要,包括评估肿瘤范围、AFP 水平、肝功能、门静脉压力和临床 PS 评分。
巴塞罗那临床肝癌 (BCLC) 分期系统是公认的用于预后预测和治疗分配的常用分期系统。
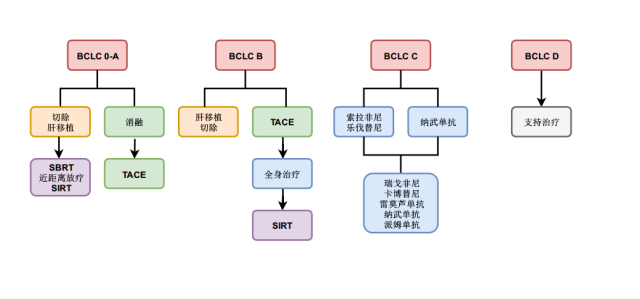
表 3. BCLC 分期和治疗方案
| BCLC 分期 | 治疗 | 基于肿瘤负荷和肝功能的指征限制 | 替代治疗(尚未获得 EMA 批准) | 替代治疗 |
0-A 单个任意大小肿瘤灶,或至多 3 个肿瘤灶 ≤ 3 cm 肝功能良好 ECOG 行为状态 0 分 | 切除术 肝移植 热消融 TACE(经动脉化疗栓塞) | 肝脏大小和功能足够 ≤ 5 cm ≤ 3 个 ≤ 3 cm,不与血管或胆管相邻 具有切术及热消融的禁忌;作为等待肝移植的桥梁治疗 | SBRT(立体定向放射治疗) HDR 近距离放射治疗 SIRT(选择性内部放疗) | |
B 多病灶 肝功能良好 ECOG 行为状态 0 分 | TACE | 5-10 cm,肿瘤结节可通过超选择性导管插入术进行 | 移植 切除 全身治(TACE 失败后/难治性) SIRT(TACE 失败后/难治性) | |
C 门脉受侵 肝外转移 肝功能良好 ECOG 行为状态 1-2 分 | 索拉非尼(一线) 瑞戈非尼(二线) | Child-Pugh A Child-Pugh A,索拉非尼耐药 | 乐伐替尼(一线) 卡博替尼(二线) 雷莫芦单抗(AFP 高负荷,二线) | 纳武单抗(二线) 派姆单抗(二线) SIRT(肝脏受限,肝功能良好,无全身治疗可行) |
D 终末期肝功能 ECOG 行为状态 3-4 分 | 支持治疗 |
虽然有证据表明 FDG 摄取较高与分化差、肿瘤大小、血清 AFP 水平和微血管侵犯存在相关性,但没有证明进行 FDG-PET 扫描作为分期方式的临床益处。
通过 Child-Pugh 评分系统(血清胆红素,血清白蛋白,腹水,凝血酶原时间和肝性脑病)对肝功能进行评估。在 Child-Pugh A 组中,ALBI 评分的测量能够将该组分为最佳预后(ALBI 1)和较低预后(ALBI 2),中位生存期分别为 26 和 14 个月。
临床上出现食管静脉曲张和/或脾肿大、血小板计数为 100×109/ L 提示门静脉高压症,也可通过经颈静脉途径(肝静脉压力梯度> 10 mmHg)进行有创测量。
治疗
图 1.HCC 治疗方案取决于 BCLC 分期
1. 早期和中期 HCC
Child-Pugh A 级不伴内源性门脉高压的患者被认为是次要/主要肝切除术(LR)的良好候选者。
仔细挑选的 Child-Pugh B 级伴/不伴门静脉高压的患者可能是小手术切除的候选者。
肝硬化的 LR 最好采用腹腔镜切除术。
米兰标准是原位肝移植(OLT)的筛选标准,具体为:1 个病灶,<5 cm;≤ 3 个病灶,每个病灶<3 cm;没有肝外受累表现;没有大血管受侵证据。对于符合米兰标准的患者建议行 OLT,预计复发率<10%,5 年生存率为 70%。
在其他更宽泛的标准中,只有 UCSF 标准得到前瞻性验证,也可以作为 OLT 患者筛选的标准。具体为:1 个病灶,≤ 6.5 cm;≤ 3 个病灶,最大 ≤ 4.5 cm,总直径 ≤ 8 cm。
对于移植患者,预计等待时间较长(>3 个月)的情况下,可以为患者提供切除、局部消融或 TACE,以最大限度地降低肿瘤进展的风险并为移植提供「桥梁」。
OLT,LR 或局部消融后,不推荐对 HCC 患者进行辅助治疗。
通过 RFA 或 MWA 进行热消融可能被推荐为非常早期疾病的一线治疗(BCLC 0)。如果因为肿瘤位置导致热消融后局部失败风险高,可选择高共形 HDR 放射性消融和 SBRT 作为替代方案。
对于初始和重复 TACE 的候选者,目前不推荐在临床试验之外使用基于未知预测值预后评分的治疗算法。
传统的基于碘油的 TACE 是中间型 HCC 患者的标准治疗方法,尽管使用 DEB-TACE 可以最大限度地减少化疗的全身副作用。在临床实践中不推荐 TACE 与索拉非尼等药物(序贯或同时)的组合。
SIRT 不建议作为中期或晚期 HCC 患者的一线治疗。
(2)晚期 HCC
化疗尚未在随机试验中被证明可以提高 HCC 的生存率,因此不推荐作为标准治疗。
索拉非尼是晚期 HCC 患者和不符合或不进行局部治疗的中期(BCLC B)患者的标准治疗方案,建议用于肝功能良好和 ECOG PS 0-2 分的患者。
乐伐替尼与索拉非尼相比具有非劣效性,可作为晚期 HCC 患者的一线治疗,要求患者不伴主要门静脉侵犯、胆管明显浸润、肿瘤占总肝脏容量 ≥ 50%,仍待 EMA 批准。
对索拉非尼耐受但有进展的患者,瑞格非尼可作为标准治疗方法,建议用于肝功能保存良好和 ECOG PS 0-1 分的患者。
卡博替尼可用于 1 或 2 种全身治疗后进展,且肝功能良好、ECOG PS 0-1 的患者,仍待 EMA 批准。
雷莫芦单抗可用于基线 AFP ≥ 400ng / mL、肝功能保存良好且 ECOG PS 0-1 的患者的二线治疗,仍待 EMA 批准。
使用纳武单抗和派姆单抗的免疫疗法可以考虑用于在酪氨酸激酶抑制剂下不耐受或已经进展的患者,仍待 EMA 批准。
随访、长期影响和生存
应使用动态 CT 或 MRI 研究评估肿瘤活动性,并定义为动脉期摄取造影剂。
建议使用 mRECIST 评估局部区域治疗的反应/进展 ,但仍需要进一步的前瞻性验证。有限的证据表明 mRECIST 可以比 RECIST v1.1 更准确地预测 OS。
表 4. RECIST v1.1 VS mRECIST 对 HCC 的反应评估
| RECIST | mRECIST | |
| CR | 所有靶病灶消失 | 所有靶病灶动脉期增强显影均消失 |
| PR | 靶病灶直径之和比基线水平减少至少 30% | 靶病灶(动脉期增强显影)的直径之和缩小 ≥ 30% |
| SD | 靶病灶减小的程度未达到 PR,增加的程度未达到 PD,介于二者之间 | 靶病灶(动脉期增强显影)缩小未达到 PR 或增加未达到 PD |
| PD | 靶病灶直径之和增加至少 20%,或出现新病灶 | 靶病灶(动脉期增强显影)的直径之和增加 ≥ 20% 或出现新病灶 |
对于接受根治治疗(切除术或 RFA)的患者,前 2 年每 3 个月随访应包括肝功能失代偿的临床评估,以及通过复查动态 CT 或 MRI 以早期发现复发,此后每 6 个月监测一次。
对于接受 TACE 或全身药物治疗的晚期 HCC 晚期患者,每 3 个月进行肝功能失代偿的评估和复查动态 CT 或 MRI 来发现肿瘤进展的迹象,以指导治疗决策。
