化疗引起的恶心呕吐(CINV)是肿瘤患者化疗过程中最常见、主观感受最痛苦的不良反应之一。据统计,如果不进行止吐预防,70%-80% 的化疗患者会出现 CINV 1。CINV 造成患者生活质量下降、代谢紊乱、营养失调、体重减轻、甚至对化疗产生恐惧,使治疗依从性下降,严重时不得不减量甚至终止抗肿瘤治疗 2。美国国立综合癌症网络(NCCN)等权威指南明确指出,对于接受中高度致吐化疗的患者必须给予标准化、全程化的预防和管理 3。
化疗前后 CINV 的全程预防和管理是各大指南推荐的标准方案。接受 HEC 和 MEC 化疗的患者,恶心呕吐风险至少持续 3 天和 2 天,因而仍需积极予以防护 3。特别对于多日化疗呕吐的叠加,更需要进行全程的止吐保护。我国绝大多数的 CINV 用药为针剂,患者一旦出院,CINV 的预防很难维持和实施,患者在院外发生的延迟性恶心呕吐状况成为盲区。
2018 年 7 月,日本苏爱康公司的善可舒®(格拉司琼透皮贴片)作为全球首个且唯一一个止吐类透皮贴片被中国国家药品监督管理局(CNDA)正式批准,用于预防需要接受连续 3-5 天的中度致吐性化疗(MEC)和/或高度致吐性化疗(HEC)引起的恶心和呕吐。善可舒®7 天的稳定疗效可满足预期性恶心呕吐,急性/延迟性恶心呕吐等不同阶段的患者需求,使全程管理特别是出院后的预防保护成为了可能。其无创的给药新途径也提高了癌症患者在整个化疗风险期内治疗的依从性和便捷性,改善癌症化疗患者的生活质量。
传统 vs 创新:格拉司琼透皮贴片的独特优势
传统的 5-HT3 受体拮抗剂半衰期较短,需多次反复给药,患者依从性较低。由 ProStrakan Inc. 研发制造的善可舒 ®作为全球唯一一个格拉司琼透皮贴片,具有独特的骨架结构,定量缓释,血药浓度稳定持久 。每张贴片实际大小是 52 cm2,含有 34.3 mg 格拉司琼,每 24 小时释放 3.1 mg,释放长达 7 天 4。
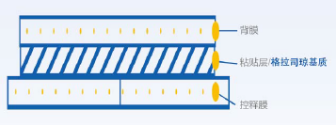
(格拉司琼透皮贴片特有的骨架结构)
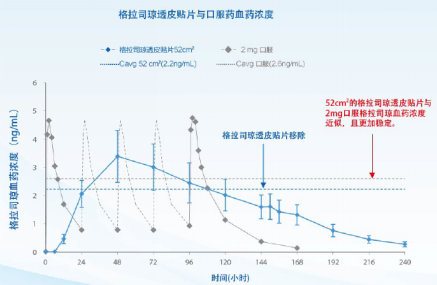
(格拉司琼透皮贴片与口服药血药浓度)
全球及国内多项临床数据证实:格拉司琼透皮贴片安全有效
善可舒 ®的疗效稳定持久,覆盖整个化疗周期,真正实现了 CINV 的全程管理。全球临床研究显示,格拉司琼透皮贴片对多日的 MEC/HEC 预防 CINV,疗效不劣于静脉和口服格拉司琼 5;对于 MEC 预防 CINV,疗效不劣于帕洛诺司琼 6。全球多中心、随机、活性对照、双盲、平行组、III 期非劣效性注册临床研究 5,共纳入 641 例接受首次多日 MEC 或 HEC 方案的癌症患者,多日化疗前随机接受口服格拉司琼 (2 mg/d D3-5)(n = 313) 或格拉司琼皮贴片 (一贴 D7 移除)(n = 308),比较两组控制 CINV 疗效及安全性、耐受性和黏贴性。善可舒与口服格拉司琼完全控制率(60% vs 65%) 无显著差异。
中国 III 期随机、双盲、阳性药平行对照的注册研究中 7,313 例患者随机进入格拉司琼透皮贴片组 (格拉司琼透皮贴片,1 贴,贴敷 7 d) 或口服格拉司琼片组 (格拉司琼片,2 mg/d,口服,≥ 2 d)。观察从化疗开始至末剂化疗给予结束后 24 h 期间恶心呕吐达到完全控制的患者比例。数据显示,在整个化疗周期内,透皮贴片与口服片剂在疗效上没有差异,对化疗引起的恶心呕吐有稳定而持续的作用。
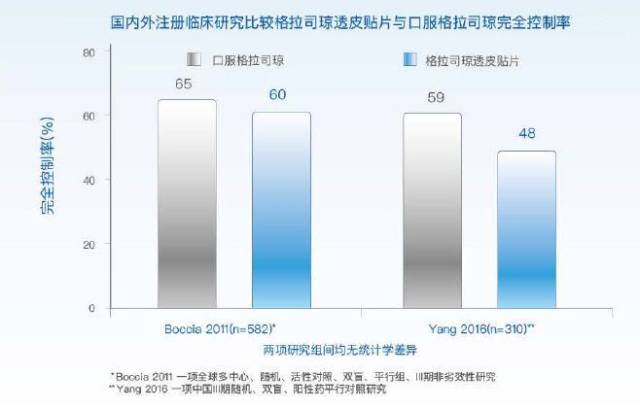
(格拉司琼透皮贴片国内外注册临床疗效)
研究证实,格拉司琼透皮贴片的安全性和耐受性良好,不会对 QT 间期产生临床影响。且药物相关不良事件的发生率极低,消化道症状如便秘和腹痛是最常见的不良事件,发生率与口服制剂近似 5,7。
此外,格拉司琼透皮贴片剂型使用方便,患者可自行无创给药,每疗程一次,贴于上臂外侧,减少了口服及静脉的给药次数,极大提高了治疗的依从性,尤其对于在院外需要给予或维持 CINV 保护的患者,透皮贴片是提供持续稳定疗效的最佳选择。
多家权威指南推荐:CINV 全程管理新选择
作为唯一的透皮贴片,善可舒 ®于 2008 年首先在美国上市,2011 年起被美国国立综合癌症网络(NCCN)8/美国临床肿瘤学会(ASCO)止吐药应用指南所推荐 9;2014 年癌症支持治疗多国协会(MASCC)/欧洲医学肿瘤学会(ESMO)止吐指南 10及中国肿瘤治疗相关呕吐防治指南共同推荐使用 2。
善可舒 ®的成功获批,为化疗患者的恶心呕吐预防提供了一种疗效持久稳定、无创的给药新途径,使 CINV 的全程保护能便捷的得以实现,为院内院外的患者提供了方便的治疗选择,切实帮助癌症患者长期坚持规范化治疗,改善患者生活质量。
参考文献
1 Wiser W, Berger A. Practical management of chemotherapy-induced nausea and vomiting. Oncology (Williston Park). 2005; 19(5): 637-645.
2 中国抗癌协会癌症康复与姑息治疗专业委员会;中国临床肿瘤学会抗肿瘤药物安全管理专家委员会. 肿瘤治疗相关呕吐防治指南(2014 版). 临床肿瘤学杂志 .2014; 19(3): 263-273.
3 NCCN. Clinical Practice Guidelines in Oncology. Antiemesis. 2017; Version 2
4 Howell J, Smeets J, Drenth HJ, et al. Pharmacokinetics of a granisetron transdermal system for the treatment of chemotherapy-induced nausea and vomiting. J Oncol Pharm Pract. 2009; 15(4): 223-231.
5 Boccia RV, Gordan LN, Clark G, et al. Efficacy and tolerability of transdermal granisetron for the control of chemotherapy-induced nausea and vomiting associated with moderately and highly emetogenic multi-day chemotherapy: a randomized, double-blind, phase III study. Support Care Cancer. 2011; 19(10): 1609-1617.
6 Seol YM, Kim HJ, Choi YJ, et al. Transdermal granisetron versus palonosetron for prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy: a multicenter, randomized, open-label, cross-over, active-controlled, and phase IV study. Support Care Cancer. 2016; 24(2): 945-952.
7 Yang LQ, Sun XC, Qin SK, et al. Transdermal granisetron for the prevention of nausea and vomiting following moderately or highly emetogenic chemotherapy in Chinese patients: a randomized, double-blind, phase III study. Chin Clin Oncol. 2016; 5(6): 79.
8 NCCN. Clinical Practice Guidelines in Oncology. Antiemesis. 2011; Version 3
9 Basch E, Prestrud AA, Hesketh PJ, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2011; 29(31): 4189-4198.
10 MASCC/ESMO Antiemetic Guideline
