肿瘤介入治疗是指在影像设备的引导和监视下,利用穿刺针、导管等介入器材,通过人体自然孔道或微小的创口将特定的器械或药物导入肿瘤部位进行微创治疗的技术。肿瘤介入治疗具有:「靶向、微创、安全、高效」的特点 ,在肿瘤的综合治疗中发挥着重要的作用[1]。
肿瘤介入治疗可分为血管介入治疗和非血管介入治疗。血管内介入治疗主要包括经导管动脉灌注化疗及栓塞治疗(TACE),非血管介入治疗主要指经皮穿刺肿瘤消融术 [1]。现笔者对肿瘤介入治疗在 2017 年的进展热点分上、下两篇进行简单回顾,内容将主要包括载药微球经导管动脉化疗栓塞治疗和放疗栓塞两个方面。
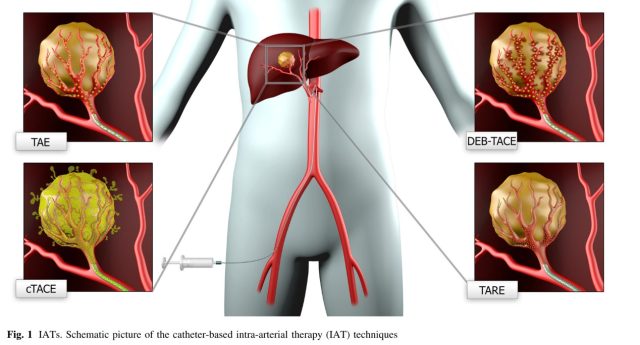
载药微球经导管动脉化疗栓塞治疗(DEB-TACE)
TACE 是治疗富血供肿瘤尤其是中晚期肝癌的主要手段之一,TACE 因其有效安全得到广泛认可。传统的 TACE(Conventional TACE,cTACE)治疗使用的栓塞剂为超液态碘油与其它化疗药物的混合乳剂,碘油携带化疗药物被截留在肿瘤细胞内发挥杀伤肿瘤细胞作用。通常情况下,碘油保留在肝细胞癌(HCC)病灶中 8-12 个月,并且可以在 4 周内从正常或肝硬化肝实质细胞中洗出。在输注抗癌药物乳剂后使用栓塞剂进行栓塞,不仅有助于将碘油选择性保留在 HCC 中,而且还能减少药物从肿瘤细胞中清除,并可以诱导缺血性坏死 [2]。
新型栓塞剂是近年来研究的热点之一,其中载药微球又称药物洗脱微球 ( drug-eluting bead,DEB) 由于同时具有栓塞和载药的特性,是一种潜在的可以应用于临床的优良化疗栓塞材料,因而成为研究热点 [3]。DEB 通过离子交换作用吸附抗肿瘤药物(如阿霉素、表阿霉素和柔红霉素、伊立替康、拓扑替康和索拉菲尼等),使其平稳释放化疗药物,使得肿瘤局部维持较高血药浓度,而全身血药浓度较低从而降低副作用 [4,5]。
国际上多家研究报道了载药微球治疗的安全性及有效性,大多数认为载药微球疗效确切、副反应相对较小 ,DEB-TACE 联合抗血管生成药物亦是一种可供选择的治疗方案,但其有效性需要更多的数据支持[6]。
1. DEB-TACE 疗效研究
1)Asayama 等 [7]收集 25 例肝癌患者(49 个病变目标)行 DEB-TACE 术,有 10 例患者部分/完全缓解(10/25),病变部位客观缓解率 ORR 为 63.3%(31/49),病灶位于肝脏内侧或尾状节段的肿瘤位置治疗效果较差。
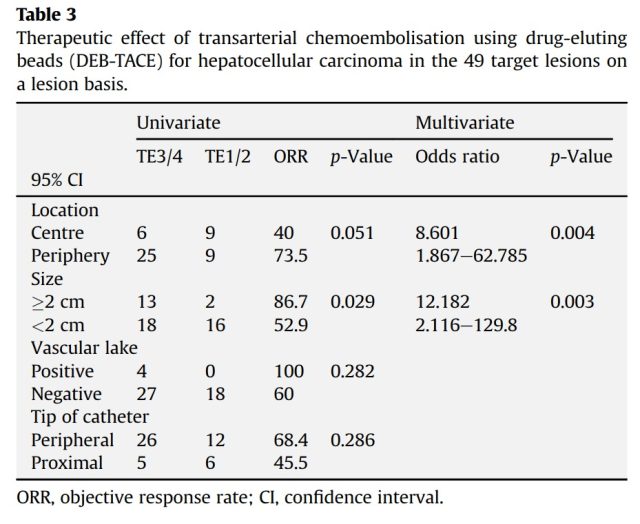
2)Camillo Aliberti 等[8]研究的 421 例 HCC 患者,DEB-TACE 吸附多柔比星治疗,总有效率为 3 个月时为 94.5%,6 个月时为 99.5%,中位总生存期为 42.0 个月。
2. DEB-TACE 与 cTACE 对比研究
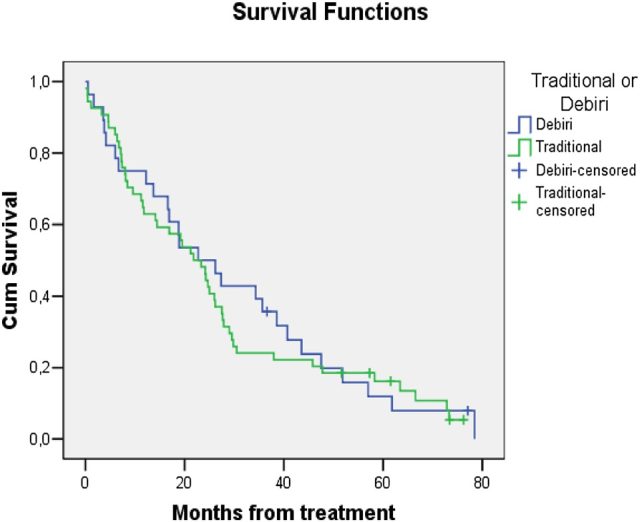
1)M. Massani[9]回顾性地分析了 2006 年至 2012 年间 82 名接受 cTACE 或 DEB-TACE 的非手术患者,包括 54 名患者接受 cTACE 治疗和 28 名患者接受 DEB-TACE 治疗,随访至少 12 个月,30 天后通过影像学 CT 检查评估疗效,在 DEB-TACE 组患者中位生存时间为 22.7 个月(CI 11.6-33.8),而 cTACE 组为 21.8 个月(CI 15.7-27.9)。生存分析显示 DEB-TACE 组和 cTACE 组生存时间没有差异,死亡概率与患者的 Child-Pugh 评分显著相关。
2)Cucchetti 等人最近的一篇论文评估 5 项随机对照试验和 11 项观察性研究。他表示,DEB-TACE 患者住院时间较短,可能是与 TACE 术后综合征的风险有关,并认为 DEB-TACE 相对于 cTACE 可以提高患者的生活质量。
3)徐文杰 [10]等的研究表明,载药微球+碘油乳化液 TACE 术相比单纯应用碘油乳化液的 TACE 术,1 月后肿瘤坏死率高;前者与明胶海绵+碘化油的 TACE 术相比,1 月后肿瘤坏死率相当,载药微球+碘油乳化液 TACE 术并发症较少。
4)陈刚 [11]对比国产 DEB-TACE 同 cTACE 在治疗不可切除肝癌的安全性及有效性,疾病控制率及缓解率无统计学差异,且 DEB-TACE 较 cTACE 更易发生肝脏局部并发症。
综合以上研究,两种治疗都可以在肿瘤复发的情况下进行,而不会显著增加手术并发症和肝衰竭风险,但并没有证据表明 DEB-TACE 优于 cTACE 的效力,唯一显示优势的是栓塞后综合征发生率降低。
3. DEB-TACE 与抗血管生成剂联合使用研究
1)为了阻止由栓塞引起的新血管的形成,TACE 与抗血管生成剂的组合成为一种新的探索,抗血管生成药物和免疫治疗药物在 HCC 治疗中也是有益的 [11]。Pawlik 等人进行了一项小型 II 期前瞻性单中心研究,以评估 35 例晚期 HCC 患者的 DEB-TACE 和索拉菲尼的安全性和有效性。尽管大多数患者经历至少一种 3-4 级毒性,但大部分较小。
2)为了避免诱导肿瘤新生血管形成,DEB 可联合抗血管生成类靶向药物,多靶点酪氨酸激酶抑制剂如舒尼替尼(Sunitinib)和凡德他尼(Vandetanib)以及抗 VEGF 抗体贝伐单抗(Bevacizumab)等也可供选择,但需要更多证据支持 [12]。对 50 例不能切除的 HCC 患者进行的 II 期试验显示,长期应用索拉菲尼治疗联合 DEB-TACE 可改善晚期 HCC 患者的 OS(20.4 个月),根据 EASL,索拉菲尼加 DEB-TACE 的客观反应率为 58%。这些研究发现索拉菲尼和 DEB-TACE 联合治疗的具有一安全性和有效性,而且没有观察到与索拉菲尼有关的意外不良事件。但也有研究者认为,索拉非尼联合 DEB-TACE 相比单纯 DEB-TACE 可能不会有更好的 TTP,接受索拉菲尼联合 DEB-TACE 与接受安慰剂联合 DEB-TACE 的受试者的中位 TTP 是相似的,这都有待进一步探讨。
4. DEB-TACE 疗效相关因素研究
载药微球的大小影响 DEB-TACE 治疗效果。关于此专家的共识是:根据个体患者和肿瘤的特点,应该考虑小的栓塞颗粒尺寸(例如 100-300μm)[14],因为它们可以被注入肿瘤内部或肿瘤附近,实现精确的药物输送和栓塞[13]。在过去的十五年中,为 DEB-TACE 开发了许多较小直径的颗粒。这些新的 40μm 直径的药物洗脱珠理论上更深入到肿瘤循环小动脉中,减少了由于经动脉栓塞导致的缺氧缺血性新血管生成现象。据报道,接受 DEB 粒径为 100-300μm 的患者总生存期为 48.6 个月,DEB 粒径为 300-500μm(和别患者为 500-700μm)的患者总中位生存期为 43.8 个月,无明显统计学差异;70-150μm 的粒径有效且耐受性良好。然而,这一研究仅限于巴塞罗那分期(BCLC)A / B 期 HCC 患者。
5. DEB-TACE 的经济优势
DEB-TACE 展现出明显经济成本优势。Waleed Fateen 等 [15] 研究提出:根据预定的标准治疗路径,未调整的平均成本差异为 3770.30 英镑(cTACE = 9070.44 英镑,DEB-TACE = 5300.14 英镑),根据成本模型的结果显示,成本差异为 2715.33 英镑(95%CI 580.88-4849.77 美元)。可得出即使考虑到 DEB-TACE 的额外费用,每名患者的总体治疗费用也低于 cTACE。
综上所述,DEB-TACE 对晚期肝癌疗效确切,但病灶位于肝脏内侧或尾状节段的肿瘤位置治疗效果可能较差,该结论需进一步研究探索。与 cTACE 相比,DEB-TACE 并没有显著延长患者生存期,但术后发生综合并发症风险降低,对患者生存质量有显著提高。DEB-TACE 联合抗血管生成药物是未来研究趋势,目前研究表明,加入索拉菲尼并没有显著增加患者不良反应,但相较于单用 DEB-TACE 对疾病有效率是否有提高需要更多研究证实。BCLC A/B 期 HCC 患者,栓塞颗粒的尺寸选择 70-150μm 的粒径有效且耐受性良好,不仅提高患者生存质量方面,在经济方面 DEB-TACE 较 cTACE 也有显著优势;对于 DEB-TACE 在疾病控制,术后并发症,联合抗血管生成药探索及提高生存质量等方面还需要更大样本的进一步研究。
参考文献:
[1] 李晓光. 肿瘤介入治疗进展与研究方向. 中华临床医师杂志(电子版), 2012, 6(10):
[2] Meier JM, Behr SC, Jordan E, et al. Intraperitoneal metastases after transarterial embolization of hepatocellular carcinoma: An observational study. Abdom Radiol (NY), 2017, 42(6): 1794-1798.
[3] Pesapane F, Nezami N, Patella F, et al. New concepts in embolotherapy of HCC. Med Oncol, 2017, 34(4): 58.
[4] Fuchs K, Duran R, Denys A, et al. Drug-eluting embolic microspheres for local drug delivery – State of the art. Journal of Controlled Release, 2017, 262(127-138.
[5] 姜松, 李桂杰, 周祝谦, et al. CalliSpheres 载药栓塞微球治疗中晚期肝癌临床效果评价. 中华介入放射学电子杂志, 2017, 03): 174-178.
[6] Kurniawan J, Sulaiman AS, Matondang S, et al. Complete Remission after Sequential Therapy of Drug Eluting Beads Transarterial Chemoembolization and Liver Resection in Large Solitary Nodule Hepatocellular Carcinoma. Case Reports Hepatol, 2017, 2017(3682614.
[7] Asayama Y, Okamoto D, Ushijima Y, et al. Predictors of therapeutic effect of transarterial chemoembolisation using drug-eluting beads for hepatocellular carcinoma. Clin Radiol, 2017, 72(9): 780-785.
[8] Camillo Aliberti, MD, Riccardo Carandina, et al. Transarterial Chemoembolization with Small Drug-Eluting Beads in Patients with Hepatocellular Carcinoma: Experience froma Cohort of 421 Patients at an Italian Center. J Vasc Interv Radiol ,2017; 28:1495–1502
[9] Massani M, Stecca T, Ruffolo C, et al. Should we routinely use DEBTACE for unresectable HCC cTACE versus DEBTACE: a single-center survival analysis. Updates Surg, 2017, 69(1): 67-73.
[10] 徐文杰, 曹刚, 张根山, et al. 聚乙烯醇栓塞微球可载药微球介入治疗中晚期肝癌的临床疗效及安全性观察. 实用癌症杂志, 2017, 12): 1999-2001.
[11] 陈刚. 国产载药微球经动脉化疗栓塞治疗不可切除原发性肝癌的临床研究. 浙江大学学报:医学版, 2017, 46(1):
[12] Hagan A, Phillips GJ, Macfarlane WM, et al. Preparation and characterisation of vandetanib-eluting radiopaque beads for locoregional treatment of hepatic malignancies. Eur J Pharm Sci, 2017, 101(22-30.
[13] 赵倩, 颜志平. 载药微球经导管动脉化疗栓塞治疗肝癌研究进展. 介入放射学杂志, 2017, 11): 1052-1056.
[14] Fateen W, Khan F, O'neill RJ, et al. Healthcare costs of transarterial chemoembolization in the treatment of hepatocellular carcinoma. J Hepatocell Carcinoma, 2017, 4(123-130.
